Функції сечової кислоти. Що це за елемент? Шляхи регенерації пуринових нуклеотидів
1. Чи є потужним стимулятором центральної нервової системи, пригнічуючи фосфодіестеразу, яка служить посередником дії гормонів адреналіну і норадреналіну. Сечова кислота пролонгує (подовжує) дію цих гормонів на центральну нервову систему.
2. Володіє антиоксидантними властивостями - здатна взаємодіяти з вільними радикалами.
Рівень сечової кислоти в організмі контролюється на генетичному рівні. Для людей з високим рівнем сечової кислоти властивий високий життєвий тонус.
Однак підвищений вміст сечової кислоти в крові ( гіперурикемія) Небезпечно. Сама сечова кислота і, особливо, її солі урати (натрієві солі сечової кислоти) погано розчиняються у воді. Навіть при незначному підвищенні концентрації вони починають починають випадати в осад і кристалізуватися, утворюючи камені. Кристали сприймаються організмом як чужорідний об'єкт. У суглобах вони фагоцитуються макрофагами, самі клітини при цьому руйнуються, з них звільняються гідролітичні ферменти. Це призводить до запальної реакції, що супроводжується сильними болями в суглобах. Таке захворювання називається подагра. Інше захворювання, при якому кристали уратів відкладаються в ниркової балії або в сечовому міхурі, відомо як мочекам'яна хвороба.
Для лікування подагри і сечокам'яної хвороби застосовуються:
інгібітори ферменту ксантиноксидази. Наприклад, алопуринол - речовина пуринової природи, є конкурентним інгібітором ферменту. Дія цього препарату призводить до підвищення концентрації гипоксантина. Гіпоксантин і його солі краще розчинні у воді, і легше виводяться з організму.
дієтичне харчування, що виключає продукти, багаті нуклеїновими кислотами, пуринів і їх аналогами: ікра риб, печінка, м'ясо, кава і чай.
солі літію, оскільки вони краще розчиняються у воді, ніж урати натрію.
Синтез нуклеїнових кислот синтез мононуклеотидів
Для синтезу мононуклеотидів de novo необхідні дуже прості речовини: CO 2 і рибоза-5-фосфат (продукт 1-го етапу ГМФ-шляху). Синтез відбувається з витратою АТФ. Крім цього, необхідні замінні амінокислоти, які синтезуються в організмі, тому навіть при повному голодуванні синтез нуклеїнових кислот не страждає.
РОЛЬ АМІНОКИСЛОТ У синтезі мононуклеотидів
аспарагин. Є донором амидной групи.
аспарагінова кислота.
а) Чи є донором аміногрупи
гліцин
а) Чи є донором активного З 1.
б) Бере участь в синтезі всієї молекулою.
Серін. Є донором активного З 1.
ПЕРЕНЕСЕННЯ одинвуглецевого ФРАГМЕНТІВ
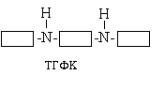
В організмі людини існують ферменти, які можуть витягувати з деяких амінокислот З 1 -группу. Такі ферменти є складними білками. Як коферменту містять похідне вітаміну В З - фолієвої кислоти. Фолієвої кислоти багато в зеленому листі, до того ж, цей вітамін синтезується мікрофлорою кишечника. У клітинах організму фолієва кислота (ФК) двічі відновлюється (до неї приєднується водень) за участю ферменту НАДФ . Н 2 -залежною редуктази, І перетворюється в тетрагідрофолієву кислоту (ТГФК).
Активний З 1 витягується з гліцину або серину.
У каталітичному центрі ферменту, що містить ТГФК, є дві -NH-групи, які беруть участь у зв'язуванні активного З 1. Схематично процес можна уявити так:
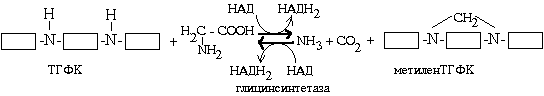
НАДН 2, який утворюється в зворотної реакції, може бути використаний для відновлення пірувату в лактат (гліколітична оксідоредукція). Реакція каталізується ферментом гліцінсінтетазой. Після цього метилен-ТГФК відділяється від білкової частини ферменту, і потім можливі два варіанти її перетворень:
Метилен-ТГФК може стати небелковой частиною ферментів синтезу мононуклеотидів.
Метиленова угруповання може видозмінюватися до:
Ці угруповання пов'язані тільки з одним з атомів азоту ТГФК, але теж можуть стати субстратами для синтезу мононуклеотидів.
Тому будь-яка з угрупувань, пов'язана з ТГФК, називається активним З 1.
Для синтезу будь-якого з нуклеотидів потрібно активна форма рибоза-фосфату - фосфорібозілпірофосфат (ФРПФ), що утворюється в наступній реакції:
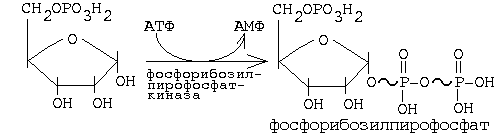
Фосфорібозілпірофосфаткіназа (ФРПФ-кіназа) є ключовим ферментом для синтезу всіх мононуклеотидів. Відзначено зниження цей фермент за принципом негативного зворотного зв'язку надлишком АМФ і ГМФ. При генетичному дефекті ФРПФ-кінази спостерігається втрата чутливості ферменту до дії своїх інгібіторів. В результаті зростає продукція пуринових мононуклеотидів, а, значить, і швидкість їх руйнування, що призводить до збільшення концентрації сечової кислоти - спостерігається подагра.
Після утворення ФРПФ реакції синтезу пуринових і піримідинових мононуклеотидів різні.
ПРИНЦИПОВІ Відмінності в синтезі пуринових і піримідинових мононуклеотидів:
особливістю синтезу пуринових нуклеотидів є те, що циклічна структура пуринового азотистого підстави поступово добудовується на активній формі рибоза-фосфату, як на матриці. При циклізації виходить вже готовий пуриновий мононуклеотид.
при синтезі піримідинових мононуклеотидів спочатку утворюється циклічний структура пиримидинового азотистого підстави, яка в готовому вигляді переноситься на рибозу - на місце пірофосфату.
Синтезу пуринових мононуклеотидів (АМФ і ГМФ)
З 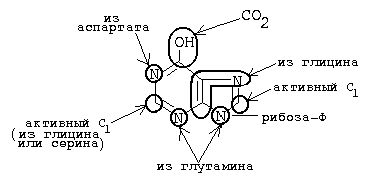 уществует 10 загальних і 2 специфічних стадії. В результаті спільних реакцій утворюється пуриновий мононуклеотид, що є загальним попередником майбутніх АМФ і ГМФ - інозінмонофосфат (ІМФ). ІМФ як азотистого підстави содердітся гипоксантин.
уществует 10 загальних і 2 специфічних стадії. В результаті спільних реакцій утворюється пуриновий мононуклеотид, що є загальним попередником майбутніх АМФ і ГМФ - інозінмонофосфат (ІМФ). ІМФ як азотистого підстави содердітся гипоксантин.
Пуриновое кільце будується з СО 2, аспарагінової кислоти, глутаміну, гліцину і серину. Ці речовини або повністю включаються в пуріновим структуру, або передають для її побудови окремі угруповання.
Аспарагінова кислота віддає аміногрупу і перетворюється в фумаровую кислоту.
Гліцин: 1) повністю включається в структуру пуринового азотистого підстави; 2) є джерелом одинвуглецевого радикала.
Серін: теж є донором одинвуглецевого радикала.
ФРПФ + глутамин -------\u003e глутамат + ФФ + фосфорібозіламін
Фермент, який каталізує цю реакцію, називається фосфорібозіламідотрансфераза. Він є ключовим ферментом синтезу всіх пуринових мононуклеотидів. Регулюється за принципом негативного зворотного зв'язку. Аллостеріческого інгібіторами цього ферменту є АМФ і ГМФ.
На другій стадії фосфорібозіламін взаємодіє з гліцином.
Третя стадія - включення вуглецевого атома, донором якого є гліцин або серин.
Потім добудовується шестичленна фрагмент пуринового кільця:
4-а стадія - карбоксилирование за допомогою активної форми СО 2 за участю вітаміну Н - біотину.
5-а стадія - амінірованіе за участю аміногрупи з аспартату.
6-а стадія - амінірованіе за рахунок аміногрупи глутаміну.
7-а, заключна стадія - включення одинвуглецевого фрагмента (за участю ТГФК), і утворюється готовий ІМФ.
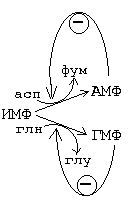 Потім протікають специфічні реакції, в результаті яких ІМФ перетворюється або в АМФ, або в ГМФ. При такому перетворенні в молекулі з'являється аминогруппа, причому в разі перетворення в АМФ - на місці ОН-групи. При утворенні АМФ джерелом азоту є аспарагінова кислота, а для освіти ГМФ необхідний глутамин.
Потім протікають специфічні реакції, в результаті яких ІМФ перетворюється або в АМФ, або в ГМФ. При такому перетворенні в молекулі з'являється аминогруппа, причому в разі перетворення в АМФ - на місці ОН-групи. При утворенні АМФ джерелом азоту є аспарагінова кислота, а для освіти ГМФ необхідний глутамин.
У деяких тканинах є альтернативний спосіб синтезу - реутилізацію (Повторне використання) пуринових азотистих основ, які утворилися при розпаді нуклеотидів.
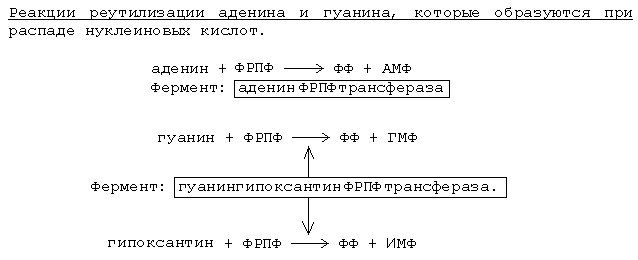
Ферменти, що каталізують реакції реутилізацію, найбільш активні в бистроделящіхся клітинах (ембріональні тканини, червоний кістковий мозок, ракові клітини), а також в тканинах головного мозку. На схемі видно, що фермент гуанінгіпоксантінФРПФтрансфераза володіє більш широкої субстратної специфічністю, ніж аденінФРПФтрансфераза - крім гуаніну, може переносити і гіпоксантин - утворюється ІМФ. У людини зустрічається генетичний дефект цього ферменту - "хвороба Леша-Нихана". Для таких хворих характерні виражені морфологічні зміни в головному і кістковому мозку, розумова і фізична відсталість, агресія, аутоагресія. В експерименті на тваринах синдром аутоагрессии моделюється шляхом згодовування їм кофеїну (пурину) у великих дозах, який пригнічує процес реутилізацію гуаніну.
Найчастішим порушенням обміну пуринів є підвищене утворення сечової кислоти з розвитком гіперурикемії. Особливістю є те, що розчинність солей сечової кислоти (уратів) в плазмі крові невелика і при перевищенні порога розчинності в плазмі (близько 0,7 ммоль / л) вони кристалізуються в периферичних зонах зі зниженою температурою.
Залежно від тривалості і тяжкості гіперурикемія проявляється:
- Поява тофусів (грец. tophus - пористий камінь, туф) - відкладення уратних кристалів у шкірі та підшкірних шарах, в дрібних суглобах ніг і рук, в сухожиллях, хрящах, кістках і м'язах.
- Нефропатії в результаті кристалізації сечової кислоти з ураженням ниркових канальців і мочекам'яна хвороба.
- Подагра - ураження дрібних суглобів.
Для діагностики порушень використовують визначення концентрації сечової кислоти в крові і сечі.
Порушення обміну пуринів
подагра
Коли гіперурикемія приймає хронічний характер, говорять про розвиток подагри (грец. poclos - нога, agra - захоплення, дослівно - "нога в капкані").
У крові сечова кислота знаходиться в формі її солей - уратів натрію. Через низьку розчинність урати здатні осідати в зонах зі зниженою температурою, наприклад, в дрібних суглобах стоп і пальців ніг. Накопичуються в міжклітинному речовині урати деякий час фагоцитируются, але фагоцити не здатні зруйнувати пуриновое кільце. В результаті це призводить до загибелі самих фагоцитів, до виходу лізосомальних ферментів, активації вільнорадикального окислення і розвитку гострої запальної реакції - розвивається подагричний артрит. У 50-75% випадків першою ознакою захворювання є болісна нічна біль у великих пальцях ніг.
Тривалий час подагру вважали "хворобою гурманів", проте потім увагу дослідників перемістилося до спадкового зміни активності ферментів метаболізму пуринів:
- збільшення активності ФРДФ-синтетази - призводить до надмірного синтезу пуринів,
- зменшення активності - через це ФРДФ не використовується для реутилізацію пуринових підстав, а бере участь у першій реакції їх синтезу. В результаті зростає кількість зруйнованих пуринів і одночасно підвищується їх утворення.
Обидва ферментативних порушення рецесивні та зчеплені з X-хромосомою. Подагрою страждає 0,3-1,7% дорослого населення земної кулі, співвідношення хворих чоловіків і жінок становить 20: 1.
основи лікування
Дієта - зниження надходження попередників сечової кислоти з їжею і зменшення її утворення в організмі. Для цього з раціону виключаються продукти, що містять багато пуринових підстав - пиво, каву, чай, шоколад, м'ясні продукти, печінку, червоне вино. Перевага віддається вегетаріанської дієти з кількістю чистої води не менше 2 л на добу.
До лікарських засобів лікування подагри відносять аллопуринол, за структурою схожий з Гіпоксантин. Ксантиноксидаза окисляє аллопуринол в алоксантину, а останній залишається міцно пов'язаним з ферментом і пригнічує його активність. Відбувається, образно кажучи, самогубний каталіз. Як наслідок, ксантин чи не перетворюється в сечову кислоту, і оскільки гипоксантин і ксантин краще розчинні у воді, то вони більш легко виводяться з організму з сечею.
Мочекам'яна хвороба
Сечокам'яна хвороба полягає в освіті сольових кристалів (Каменів) різної природи в сечовивідних шляхах. безпосередньо освіту сечокислих каменів становить близько 15% від усіх випадків раку молочної залози. Сечокислі камені в сечовивідних шляхах відкладаються приблизно у половинихворих подагрою.
Найбільш часто такі камені представлені в дистальних канальцях і збірних трубочках. причиною відкладення кристалів сечової кислоти є гіперурикемія і підвищене виведення уратів натрію з сечею. Головним провокуючим фактором кристалізації є збільшення кислотності сечі. При зниженні рН сечі нижче 5,75 урати переходять в менш розчинну форму (кетоформу) і кристалізуються в ниркових канальцях.
закислення сечі виникає з різних причин. Це може бути надмірне харчування м'ясопродуктами, що містять велику кількість нуклеїнових кислот, аміно кислот і неорганічних кислот, Що робить таку їжу "кислої" і знижує рН сечі. Також кислотність сечі посилюється при ацидозах різного походження.
основи лікування
Так само, як при подагрі, лікування зводиться до беспуріновой дієті і використання алопуринолу. На додаток рекомендується рослинна дієта, Яка веде до защелачиванию сечі, що збільшує в первинній сечі частку більш розчинних у воді солей сечової кислоти - уратів. Разом з цим, вже наявні кристали сечової кислоти (а також оксалатів) здатні розчинятися при подщелачивании сечі.
лікарське лікуваннянеодмінно має супроводжуватися дотриманням беспуріновой дієти з великою кількістю чистої води, В іншому випадку неминуча поява ксантинових кристалів в тканинах і ксантинових каменів в нирках.
Синдром Леша-Нихана
хвороба Л еша-Н іхана - це повна вроджена відсутність активності гипоксантин-гуанін-фосфорибозил-трансферази, Ферменту, який відповідає за реутилізацію пуринових підстав. Ознака рецесивний і зчеплений з Х-хромосомою. Вперше його описали в 1964 р в США студент-медик Майкл Леш і педіатр Вільям Ніхана.
Діти народжуються клінічно нормальними, тільки до 4-6 місяця виявляються відхилення в розвитку, а саме - відставання фізичного розвитку (з працею тримає голову), підвищена збудливість, блювота, періодичне підвищення температури. Виділення сечової кислоти можна виявити ще раніше за помаранчевої забарвленням пелюшок. До кінця першого року життя симптоми наростають, розвивається порушення координації рухів, хореоатетоз, корковий параліч, спазм м'язів ніг. Найбільш характерна ознака захворювання проявляється на 2-3-му році життя - аутоагресія або самокалічення - непереборне прагнення дітей кусати собі губи, язик, суглоби пальців на руках і ногах.
сторінка 1
Синтез сечової кислоти (з незначними виходами) був вперше здійснений чеським хіміком І.
Існує кілька синтезів сечової кислоти, що підтверджують її будова.
Відомо кілька способів синтезу сечової кислоти. З них найбільш широко застосовується і використовується для синтезу різних з'єднань пуринової групи метод Траубе.
Спільно зі своїм учнем Розеном здійснив синтез сечової кислоти.
Пізніше Траубе удосконалив свій метод синтезу сечової кислоти, отримавши 4-аміно - 2 6-діоксіпірімідін в одну стадію конденсацією сечовини з етиловим ефіром циануксусная кислоти.
Передбачається, що у ракоподібних є шлях синтезу сечової кислоти, але це припущення засноване на простий аналогії з комахами; прямих даних про важливу роль цього шляху в екскреції азоту немає.
Всі ці сполуки утворюються в якості проміжних продуктів при синтезі сечової кислоти (стор.
Реакція представляє в основному історичний інтерес, так як є одним з перших способів синтезу сечової кислоти.
Первісне вторгнення комах в наземні місцеперебування, ймовірно, відбувалося одночасно з виробленням у них активної системи синтезу сечової кислоти як кінцевого продукту азотистого обміну. Звідси вона шляхом активної секреції виводиться в просвіт мальпігієвих трубочок. Система, що складається з мальпігієвих трубочок, задньої кишки і прямої кишки, служить органом виділення води, іонів і сечової кислоти. У наземних комах на частку сечової кислоти припадає понад 80% виділяється азоту.
Сембрітцкій, отримавши 1 3-діетілмочевую кислоту из 1 3-діетілбар-бітуровой кислоти через проміжний 1 3-діетілураміл, показав, що запропонований Фішером метод синтезу сечової кислоти має загальний характер.
Сечова кислота являє для певної групи тварин такий же важливий продукт виділення, як сечовина або аміак для інших. Але про механізм синтезу сечової кислоти, а в рівній мірі і про матеріал, з якого вона утворюється, немає достовірних даних, хоча і існує деяка кількість гіпотез з цього приводу.
Найчастіше ми стикаємося з сечовий кислотою у птахів і урі-котеліческіх плазунів, так як у них основним азотистих продуктом обміну є сечова кислота, а не сечовина. У більшості птахів утворення сечової кислоти відбувається в печінці: гепатоектомія призводить у них до того, що синтез сечової кислоти припиняється, а зміст амонійного азоту в крові підвищується. Досліди з ізотопами підтвердили, що у птахів і плазунів, як і передбачалося, попередником сечової кислоти служить аміак. Сечовина не грає ролі попередника сечової кислоти і може бути використана тільки як джерело аміаку. У той час як в печінці домашньої птиці містяться всі ферменти, необхідні для утворення сечової кислоти, в печінці голуба відсутній ксантиноксидаза. Тому у голубів гипоксантин утворюється в печінці, а окислення його в сечову кислоту відбувається в нирках, де ксантиноксидаза є.
Хоча в цей час азот дійсно виділяється тільки у вигляді сечової кислоти, швидкість синтезу її (за даними про включення 14С - гліцину в пурини) падає приблизно до / 4 відповідної величини для активних тварин. Це зниження синтезу сечової кислоти відображає загальне зниження інтенсивності метаболізму в період літньої сплячки. Значна частина утворюється в цей час сечової кислоти накопичується в клітинах більшості тканин і, мабуть, бере участь тут в підтримці осмотичного рівноваги. Таким чином, кількість фактично виділяється сечової кислоти набагато зменшується. Це дуже важлива зміна, так як в період сплячки осмоляр-ність крові зростає в результаті великої втрати води і накопичення сечовини в крові для зниження пружності водяної пари крові. Сечова кислота подібним же чином використовується у морських молюсків для осморегуляции при надмірній солоності навколишнього води.
| Виділення амінного азоту у вигляді сечової кислоти у птахів, змій і ящірок. Атоми азоту сечової кислоти (показані червоним походять від ос-аминогрупп амінокислот. В молекулу сечової кислоти вони включаються дуже складним шляхом. Сечову кислоту називають кислотою, тому що вона існує в таутомерних формах, здатних іонізуватися і утворювати урати. Урати Na і К лише трохи краще розчинні у воді, ніж сама сечова кислота. | Острів Сан-Лоренцо поблизу узбережжя Перу-один з тих островів, на яких є поклади гуано. на цих островах гніздяться сотні тисяч птахів, так що за багато століть тут скупчилися цілі гори уано, що складається в основному з твердої сечової кислоти. Гуано-цінне добриво. одна тонна його варто більше 100 доларів. У другій половині минулого століття цілі флотилії вітрильних суден розвозили гуано по всьому світу, ведучи торгівлю з багатьма країнами. |
У людини та інших ссавців пуринові нуклеотиди синтезуються для забезпечення потреб організму в мономерних попередників нуклеїнових кислот, а також у з'єднаннях, що виконують інші функції, описані в гл. 34. У деяких хребетних (птахів, земноводних, рептилій) синтез пуринових нуклеотидів несе додаткову функцію - є частиною механізму, за допомогою якого виводяться надлишки азоту у вигляді сечової кислоти; такі організми називають урікотеліческімі. Організми, у яких кінцевим продуктом азотистого обміну є сечовина (як у людини), називають уреотелічеекімі. Оскільки урікотеліческіе організми видаляють «надлишки» азоту у вигляді сечової кислоти, синтез пуринових нуклеотидів у них йде інтенсивніше, ніж у уреотеліческіх. У той же час шляху синтезу пуринових нуклеотидів de novo - загальні для обох груп організмів.
Інформація про походження кожного з атомів в молекулі пуринового підстави отримана в процесі радіоізотопних досліджень, проведених на птахах, щурах і людину (рис. 35.2). На рис. 35.3 представлена схема шляху біосинтезу пуринових нуклеотидів. Перша стадія (реакція 1) - освіту 5-фосфорибозил-1-пірофосфату (ФРПФ). Ця реакція не унікальна для біосинтезу пуринових нуклеотидів. ФРПФ служить також попередником в синтезі піримідинових нуклеотидів (див. Рис. 35.15), він необхідний для синтезу NAD і NADP - двох коферментів, до складу яких входить нікотинова кислота.
Мал. 35.2. Походження атомів азоту і вуглецю пуринового кільця.
В реакції 2 (рис. 35.3), що каталізує фосфорибозил-пірофосфат-амідотрансферази, з ФРПФ і глутаміну утворюються глутамат і 5-фосфорібозіламін. Хоча можливі й інші механізми синтезу 5-фосфорібозіламін, реакція, що каталізується амідотрансферази, має найбільш важливе фізіологічне значення в тканинах ссавців.
Далі 5-фосфорібозйламін вступає в реакцію з гліцином (реакція 5); при цьому утворюється гліцінамідрібозілфосфат (гліцінамідоріботід, ГАР). Амідна група глутаміну служить джерелом атома азоту в положенні 9 молекули пурину (N-9), а гліцин-джерелом атомів вуглецю в положеннях 4 і 5 (С-4 і С-5) пуринового кільця. Цю реакцію каталізує гліцінамід-кіносішегаза. В реакції 4 атом азоту молекули гліцінамід-рибоза фосфату форміліруется В результаті цієї реакції, що каталізується гліцінамід-рибоза-фосфат-формілтрансферазой, що надходить одинвуглецевого фрагмент займе положення С-8 в формується пуриновому підставі. В реакції 5 знову бере участь глутамін - донор амидной групи. Амідування відбувається по атому С-4 формілгліцінамід-рібозілфосфата і каталізується формілгліцінамідін-рібозілфосфатеінтетазой. Приєднаний атом азоту займе в молекулі пурину положення 3.
В результаті замикання імідазольного кільця, катализируемого аміноімндазолрібозілфое-фатсінтетазой, утворюється аміноімідазол-рібозілфосфат (реакція 6). Далі синтез проходить через стадію утворення аміноімідазолкар-боксілат-рібозілфосфата (реакція 7). В результаті реакції формується карбонильная група, джерелом якої служить молекула утворюється в процесі дихання.
Атом азоту в положенні 1 відбувається з а-аміногрупи аспартату (реакція 8), інша частина якого утворює сукцінільний фрагмент в молекулі аміноімідазолсукцінілкарбоксіламід-рібозілфосфата (АІСКАР).
В реакції 9 сукцінільная група АІСКАР видаляється у вигляді фумарату. Що залишився аміноімідазолкарбоксіламід-рібозілфосфат форміліруется (реакція 10) -формілтетрагідрофолатом з утворенням амідоімідазолкарбоксіламід-рібозілфосфата; реакція каталізується відповідної формілтрансферазой. Знову приєднаний атом вуглецю, подібно атому С-8, надходить з пулу одноуглеродних фрагментів за участю тетрагідрофолату і займає в молекулі пурину положення 2.
Замикання кільця (реакція 11) відбувається за допомогою IMP-ціклогідролази, в результаті утворюється перший пуриновий нуклеотид-інозинова кислота (інозінмонофоефат; IMP).
(Див. Скан)
Мал. 35.3. Шлях біосинтезу de novo пуринів з рибоза-5-фосфату і АТР (пояснення - в тексті). або РВ.
Значення метаболізму фолатів
В процесі біосинтезу пуринових нуклеотидів (рис. 35.3) атоми вуглецю в положеннях 8 і 2 надходять відповідно від і -формілтетрагідрофолата. Останній утворюється з тетрагідрофолату, який в свою чергу є продуктом залежного дегідрогенірованія Якщо служить джерелом одноуглеродних фрагментів для багатьох акцепторів, то поставляє одинвуглецевого групу (або безпосередньо, або через стадію утворення тільки в пурини. З наведених відомостей слід, що гальмування процесів утворення розглянутих фолатів надає гальмує вплив і на синтез пуринів de novo.
Освіта АМР і GMP з IMP
Як показано на рис. 35.4 адениновую (реакції 12 і 13) і гуанінових нуклеотиди (реакції 14 і 15) утворюються шляхом амінування і відповідно окислення і амінування загального попередника-інозінмонофоефата (IMP). Амінірованіе ГМР протікає через стадію утворення проміжного з'єднання, в якому аспартат приєднується до инозиновой кислоті, утворюючи аденілосукцінат. Ця реакція нагадує реакцію 8 біосинтезу пуринів (рис. 35.3), в якій а-азот аспарагінової кислоти поставляє атом пуринового кільця. Освіта аденілосукціната каталізується аде-нілосукцінатсінтазой і відбувається за участю GTP. Видалення решти частини аспарагінової кислоти у вигляді фумарату призводить до утворення адениловой кислоти (аденозинмонофосфат; АМР). Відщеплення фумарата від аденілосукціната каталізується ферментом аденілосукціназой. Цей же фермент каталізує відщеплення фумарата від аміноімідазолсукцінілкарбоксамідрібозілфосфата (реакція 9).
Так само, в дві стадії, з IMP утворюється гуанзінмонофосфат (GMP). У першій реакції на цьому шляху (реакція 14) за участю NAD і відбувається окислення IMP з утворенням ксантінмонофосфата (ХМР). Потім ХМР амінується амідогруппой глутаміну (реакція 15). Для цього процесу необхідний АТР, що в якійсь мірі нагадує потреба в GTP при перетворенні IMP в АМР.
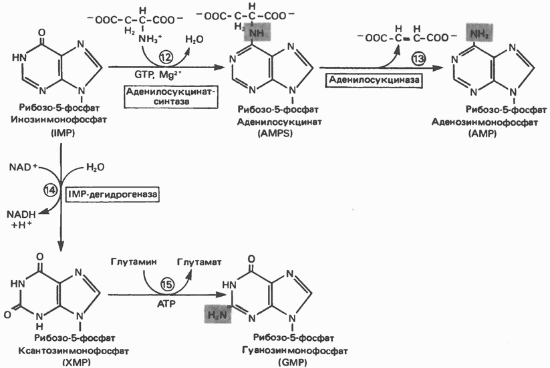
Мал. 35.4. Перетворення IMP в АМР і GMP (пояснення в тексті).
Інгібітори біосинтезу пуринів
Кілька антиметаболітів - аналогів глутаміну роблять сильний інгібуючий вплив на біосинтез пуринів. Азасерін (О-діазо-ацетил-b-серин) виступає як антагоніст глутаміну, особливо в реакції 5. Діазонорлейцін блокує реакцію 2, а -меркаптонурін поряд з іншими ефектами інгібує реакції 13 і 14 синтезу АМР і GMP відповідно. Мікофеноловая кислота пригнічує реакцію 14.
Освіта ді-і трифосфатів пуринових нуклеозидів
Перетворення АМР і GMP до відповідних ді-і трифосфати здійснюється в дві стадії (рис. 35.5). Реакції фосфорилювання - перенесення фосфатних груп від АТР-здійснюються нуклеозідмонофосфаткіназой і нуклеозіддіфосфаткііазой.
Синтез пуринових дезоксирибонуклеотидов
Синтез пуринових і піримідинових дезоксирибонуклеотидов відбувається шляхом прямого відновлення 2-вуглецю рібозного залишку відповідного рибонуклеотиду, а не шляхом синтезу de novo з 2 "-дезоксіаналога ФРПФ. Відновлення 2-вуглецевого атома рибози відбувається тільки після перетворення пуринових і піримідинових нуклеотидів в відповідні нуклеозіддіфосфати. У деяких бактерій в цьому відновному процесі бере участь кобаламин (вітамін В12). у тварин процес відновлення йде і під час відсутності вітаміну В12. відновлення риб онуклеозіддіфосфатов в дезоксірібонуклеозіддіфосфати каталізується рибонуклеотидредуктазу і вимагає участі тіоредоксіна (білковий кофактор), тіоредоксінредукчаш (флавопрогеіновий фермент) і NADPH (кофактор). Безпосереднім донором електронів для нуклеотиду є тіоредоксін, який попередньо відновлюється NADPH. Неруйнівна окислювально-відновну перетворення тіоредоксіна каталізується тіоредоксінре-дуктазой. Відновлення рібонуклеозіддіфосфата відновленим тіоредоксіна каталізується рібонуклеоз ідредуктазой (рис. 35.6).

Мал. 35.5. Реакції фосфорилювання нуклеозідмонофосфата і нуклеозіддіфосфата.
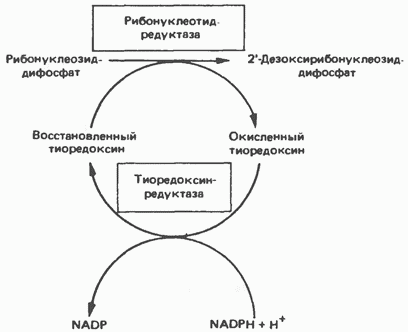
Мал. 35.6. Відновлення рібонуклеозіддіфосфата до 2-дезоксірібонуклеозіддіфосфата.
Ця складна ферментна система функціонує в клітинах тільки в період активного синтезу ДНК і поділу.
Тканинна специфічність біосинтезу пуринів
Не у всіх тканинах людини відбувається синтез пуринових нуклеотидів de novo. Еритроцити і поліморфноядерні лейкоцити не здатні синтезувати -фосфорібозіламін, і тому для утворення пуринових нуклеотидів їм необхідні екзогенні пурини. Периферичні лімфоцити здатні синтезувати невеликі кількості пуринів de novo. Встановлено, що в клітинах мозку ссавців містяться дуже малі кількості ФРПФ-амідотрансферази, на цій підставі був зроблений висновок про залежність синтезу пуринових нуклеотидів в мозку від надходження екзогенних пуринів. Виявилося, що основним місцем синтезу пуринових нуклеотидів в організмі ссавців є печінка. З неї вільні підстави або нуклеозиди потрапляють в інші тканини, які не здатні до синтезу пуринів de novo.
Шляхи регенерації пуринових нуклеотидів
Регенерацію пуринових нуклеотидів забезпечують два основних механізми. У кількісному відношенні найбільш важливий механізм фосфорібозілірованіе вільних пуринових підстав ферментами, які використовують ФРПФ в якості донора фосфорибозил. Другий спільний механізм - це фосфорилирование пуринових нуклеозидів по -гід-роксільной групі.
1. фосфорібозілірованіе пуринових підстав
У тканинах людини фосфорібозілірованіе
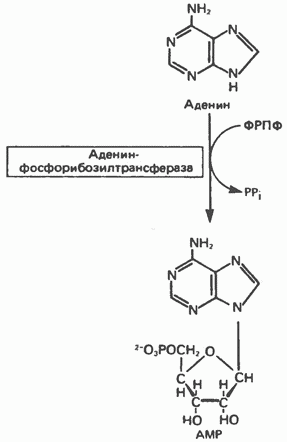
Мал. 35.7. Фосфорібозілірованіе аденіну, що каталізує аденін-фосфорібозілтрансфераза.
пуринових підстав здійснюють два ферменти. Перший - аденін-фосфорібозілтрансфераза - переносить фосфорибозил з ФРПФ на аденін. При цьому утворюється АМР (рис. 35.7). Другий - гіпокеантін-гуанін-фосфорібозілтрансфераза - каталізує фосфорібозілірованіе ксантина і гуаніну з утворенням IMP і GMP відповідно (рис. 35.8). Процес за участю другого ферменту, як буде показано нижче, протікає більш активно, ніж синтез АМР з аденіну.
2. Фосфорилування пуринових рибонуклеозид
Перетворення пуринових рибонуклеозид в пуринові рибонуклеотиди у людини каталізує фермент аденозинкіназою (рис. 35.9). Аденозинкіназою, крім того, фосфорилирует 2-дезоксиаденозин, вона проявляє також деяку активність по відношенню до гуанозин, інозин та їх 2-дезоксіпроізводним. Дезоксицитидинкіназою на додаток до фосфорилированию -дезоксіцітідіна каталізує фосфорилювання -дезоксіаде-нозіна і -дезоксігуанозіна з утворенням dAMP і dGMP.
Крім того, в тканинах людини функціонує цикл (рис. 35.10), в якому спочатку IMP, GMP і їх дезоксірібонуклеотідние аналоги при дії
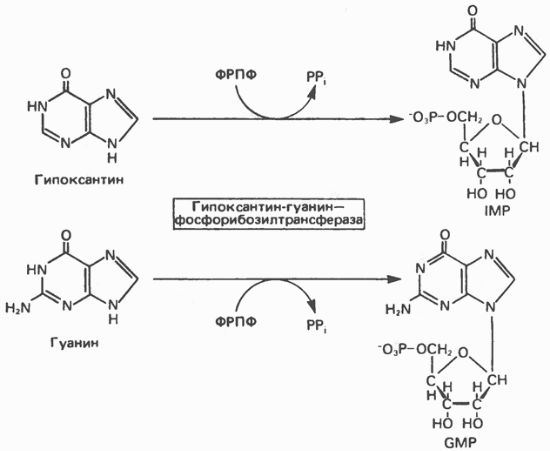
Мал. 35.8. Фосфорібозілірованіе гипоксантина і гуаніну до IMP і GMP відповідно. Обидві реакції катализируются гипоксантин-гуанін-фосфорібозілтрансфераза.
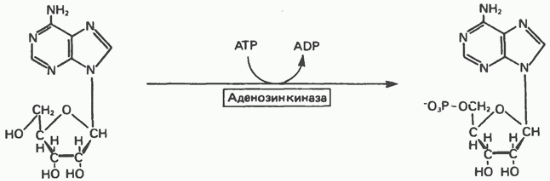
Мал. 35.9. Фосфорилювання аденозину до АМР аденозинкіназою.
пурин-5-нуклеотидази перетворюються в відповідні нуклеозиди (інозин, дезоксінозін, гуанозин і дезоксигуанозину), а потім в результаті реакції, що каталізується пуріннуклеозцдфосфорілазой, утворюються гипоксантин або гуанін і продукти фосфоролізарібозо-1-фосфат або 2-дезоксирибоза-1-фосфат. Далі за участю ФРПФ цикл завершується фосфорібозілірованіе утворилися підстав до IMP або GMP. Функція цього циклу невідома, однак не викликає сумнівів, що споживання ФРПФ в організмі людини в даному циклі вище, ніж при синтезі пуринових нуклеотидів de novo.
Бокову колію цього циклу включає перетворення IMP в АМР (реакція 12 і 13, рис. 35.4) і подальшу реакцію освіти аденозину з АМР. Ця реакція, мабуть, каталізується тієї ж пурин-5-нуклеотидаза, яка гідролізує IMP до інозину. Утворився аденозин потім або фосфорилируется аденозинкіназою до АМР, або під дією аденозіндезамінази перетворюється в инозин. У кількісному відношенні ця «інозит-нова петля» менш значима, ніж описаний вище цикл, проте реакція дезамінування аденозину дуже важлива для функціонування імунної системи.
Регуляція біосинтезу пуринів
На синтез молекули IMP витрачається енергія гідролізу шести макроергічних фосфодіефірних зв'язків АТР, при цьому в якості попередників виступають гліцин, глутамін, метенілтетрагідрофолат і аспартат. Для економії енергетичних і поживних ресурсів важлива ефективна регуляція процесу біосинтезу пуринів de novo. найважливішу
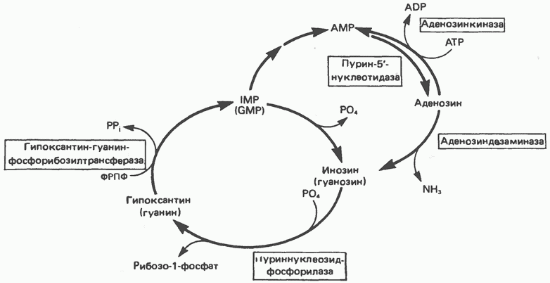
Мал. 35.10. Цикли реутилізацію пуринів, що включають взаємні перетворення AMP, IMP і, в меншій мірі, GMP; утворення відповідних рибонуклеозид і їх перетворення в пуринові рибонуклеотиди. Дезоксиаденозин, дезоксіінозін і дезоксигуанозину перетворюються на ті ж шляхами; дезоксиаденозин і дезоксигуанозину можуть безпосередньо фосфорильованій до dAMP і dGMP відповідно.
роль в цьому процесі відіграє внутрішньоклітинна концентрація ФРПФ. Вона визначається співвідношенням швидкостей його синтезу, утилізації та деградації. Швидкість синтезу ФРПФ залежить від 1) наявності субстратів синтезу, особливо рибоза-5-фосфату, і 2) каталітичної активності ФРПФ-синтази, яка в свою чергу пов'язана з внутрішньоклітинної концентрацією фосфатів, а також з концентрацією пуринових і піримідинових рибонуклеотидов, які виступають в ролі аллостеріческіх регуляторів (рис. 35.11). Швидкість утилізації ФРПФ в значній мірі залежить від інтенсивності циклу реутилізацію пуринових підстав, в ході якого ксантин і гуанін фосфорібозіліруются до відповідних рибонуклеотидов. У меншій мірі швидкість утилізації ФРПФ залежить від інтенсивності синтезу пуринів de novo. Цей висновок грунтується на наступному спостереженні: в еритроцитах і культивованих фібробластах чоловіків зі спадковим порушенням активності гіпоксантин-гуанін-фосфо-рібозілтрансферази рівень ФРПФ підвищується в кілька разів.
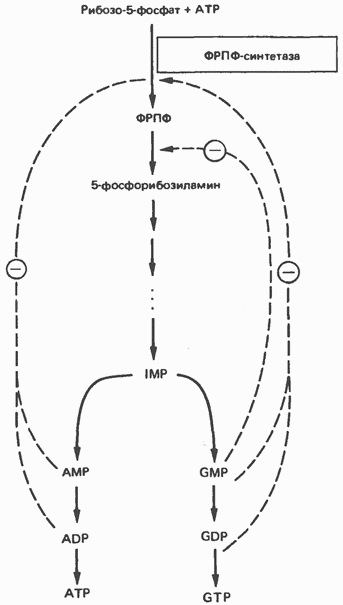
Мал. 35.11. Регуляція швидкості синтезу пуринів de novo. Суцільні лінії вказують шлях хімічних перетворень. Пунктирні лінії позначають інгібування кінцевими продуктами за принципом зворотного зв'язку.
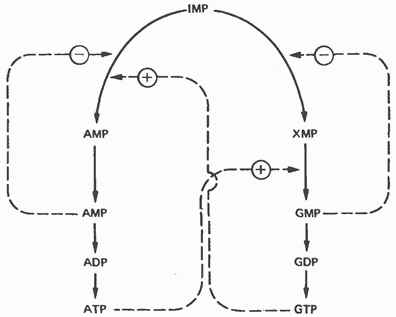
Мал. 35.12. Регуляція перетворень IMP в аденозинові і гуанозінових нуклеотиди. Суцільні лінії вказують шлях хімічних перетворень. Пунктирні лінії позначають позитивну і негативну регуляцію за принципом зворотного зв'язку.
Показано, що ФРПФ-амідотрансферази - перший з ферментів, які беруть участь в процесі синтезу пуринових нуклеотидів de novo, відзначено зниження in vitro пуриновими нуклеотидами (особливо аденозинмонофосфат і гуанозинмонофосфат) за принципом зворотного зв'язку. Ці інгібітори конкурують з субстратом - ФРПФ, останній, як з'ясувалося, займає центральне місце в регуляції синтезу пуринів de novo. Багато непрямі дані свідчать про те, що роль амідотрансферази в цьому процесі менш істотна, ніж ФРПФ-синтетази.
Освіта GMP або АМР з IMP регулюється двома механізмами (рис. 35.12). АМР регулює активність аденілосукцінатсінтетази, впливаючи за принципом зворотного зв'язку на власний синтез. GMP регулює власний синтез, діючи за тим же принципом на -дегідрогеназу. Поряд з цим освіту аденілосукціната з IMP на шляху до АМР стимулюється GTP. А освіта GMP з ксантозінмонофосфата вимагає присутності АТР. Таким чином, спостерігається істотна перехресна регуляція дівергентних шляхів метаболізму IMP. Така регуляція гальмує біосинтез одного з пуринових нуклеотидів при нестачі іншого. Гіпоксантин-гуанін-фосфор-бозілтрансфераза, що каталізує утворення з ксантина і гуаніну IMP і GMP відповідно, дуже чутлива до інгібірує цих нуклеотидів.
Відновлення рібонуклеозіддіфосфатов до дезоксірібонуклеозідціфосфатов є об'єктом складної регуляції. Цей процес (рис. 35.13) забезпечує збалансоване утворення дезоксирибонуклеотидов для синтезу ДНК.
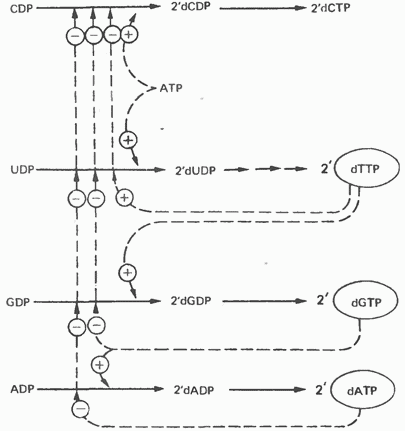
Мал. 35.13. Регуляція відновлення пуринових і піримідинових рибонуклеотидов до відповідних -дезоксірібонуклеотідов. Суцільні лінії вказують шлях хімічних перетворень Пунктирні лінії позначають позитивну і негативну регуляцію за принципом зворотного зв'язку.
катаболізм пуринів
Кінцевий продукт катаболізму пуринів у людини - сечова кислота. При обстеженні хворих із спадковою формою недостатності ферментних систем катаболізму пуринів встановлено, що 99% сечової кислоти утворюється з субстратів нуклеозідфосфорілази, що функціонує в циклі реутилізацію пуринів. Пуринові продукти нуклео-зідфосфорілазной реакції - гипоксантин і гуанін - перетворюються в сечову кислоту; проміжним продуктом є ксантин, утворюється в реакціях, що каталізуються гуаназой і ксантінокеідазой (див. рис. 35.1) в печінці, тонкому кишечнику і нирках.
Ксантиноксидаза являє собою важливу мету для фармакологічного втручання при гіперурикемії і подагри. У нижчих приматів і інших ссавців (але не в людини) сечова кислота гідролізується уриказа до аллантоина (рис. 35.14) - з'єднання, добре розчинної у воді. У птахів і наземних рептилій уриказа відсутня; в якості кінцевих продуктів метаболізму азоту (білків) і пуринів вони екскретують сечову кислоту і гуанін.
У цих організмів сформувалася урікотеліческая система, що дозволяє зберегти воду, асоційовану з сечовий кислотою, при виділенні останньої у вигляді преципітату. Якби кінцевим продуктом метаболізму азоту у них була сечовина, зберегти гідратаційну воду було б неможливо, оскільки розчинність сечовини у воді досягає 10 моль / л (концентрація значно вища за ту, яка може бути досягнута при концентруванні сечовини нирками).
Метаболізм сечової кислоти у людини (подагра)
Метаболізм сечової кислоти у людини був вивчений із застосуванням изотопно-мічених сечової кислоти, а також її попередників-гліцину і форміату. [-Мочевую кислоту ін'єктували внутрішньовенно здоровим людям і хворим на подагру, при якій в організмі накопичуються значні кількості сечової кислоти і її натрієвої солі. З розведення ін'єктувати ізотопу розраховували загальна кількість сечової кислоти, що знаходиться у водній фазі організму. Цей параметр отримав назву «розчинний уратний пул». Середня величина даного показника для 25 обстежених здорових дорослих чоловіків становила 1200 мг (розкид 866-1578 мг), а у трьох здорових жінок він коливався від 541 до 687 мг. У хворих на подагру розчинний уратний пул був значно вище і варіював від 2000 до 4000 мг для пацієнтів без подагричних вузлів, т. Е. Без відкладень урати натрію в м'яких тканинах. При важкій формі подагри, що супроводжується утворенням вузлів, розчинний уратний пул досягав величини 31 000 мг. Швидкість його поновлення у здорових людей становить 600 мг за 24 год. 18-20% видаляється з організму сечової кислоти розпадається до і
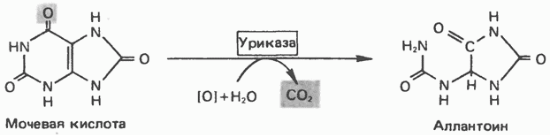
Мал. 35.14. Освіта аллантоина з сечової кислоти.
аміаку і виділяється через кишечник. Деяка кількість уратів екскретнруется з жовчю і піддається деградації кишкової мікрофлорою. Слід зазначити, що розпад сечової кислоти до у людини не пов'язаний з життєдіяльністю кишкових бактерій.
Значення уратів для організму людини не обмежується їх роллю кінцевого продукту в метаболізмі пуринів. Урати можуть функціонувати як антиоксиданти, зазнаючи неферментативне перетворення в алантоїн. Передбачається, що ендогенний антиоксидант - урат - замінює у приматів аскорбат, здатність до синтезу якого у цих ссавців втрачена. Таким чином, цілком можливо, що в процесі еволюції втрата уриказа забезпечила певні селективні переваги для тих організмів, які втратили здатність до відновлення гулонолактона в аскорбат.
Урат натрію легко фільтрується нирковими клубочками ссавців, інтенсивно реабсорбується і частково виводиться в проксимальних канальцях, потім секретується в петлі Хенлі і, ймовірно, знову реабсорбується в дистальних канальцях. За добу здоровою людиною виділяється 400-600 мг сечової кислоти. Велика кількість фармакологічних препаратів і природних сполук впливає на реабсорбцію урати натрію в ниркових канальцях і його екскрецію. Аспірин у великих дозах пригнічує як екскрецію, так і реабсорбцію сечової кислоти в нирках.
Що таке сечова кислота багато хто не знає. Ця складова не тільки сечі, але і кров'яного потоку. Вона є маркером обміну пуринів. Її концентрація в крові допомагає фахівцям діагностувати ряд захворювань, в тому числі і подагру. Спираючись на показник рівня змісту даного елемента в крові можна контролювати реакцію організму на лікування.
Що це за елемент?
В організмі людини постійно йдуть обмінні процеси. Результатом обміну можуть стати солі, кислоти, луги і безліч інших хімічних сполук. Щоб їх позбутися, їх потрібно доставити до відповідного відділу організму. Це завдання виконується за допомогою кров'яного потоку. Вони виводяться з організму у вигляді сечі і через шлунково-кишковий тракт. Таким чином, пояснюється присутність сечової кислоти в крові.
Розберемо, що це таке більш докладно. Сечова кислота - це кінцевий продукт розпаду пуринових підстав. Ці елементи потрапляють в організм разом з їжею. Пурини беруть участь в процесі синтезу нуклеїнових кислот (ДНК і РНК), енергетичних молекул АТФ, а також коферментів.
Варто зауважити, що пурини - це не єдине джерело утворення сечової кислоти. Вона може бути результатом розпаду клітин організму через захворювання або старості. Джерелом для утворення сечової кислоти може стати синтез в будь-якій клітині людського тіла.
Розпад пуринів відбувається в печінці і кишечнику. Клітини слизової оболонки виділяють спеціальний фермент - ксантиноксидаза, з яким і вступає в реакцію пурини. Кінцевим результатом цього «перетворення» є кислота.
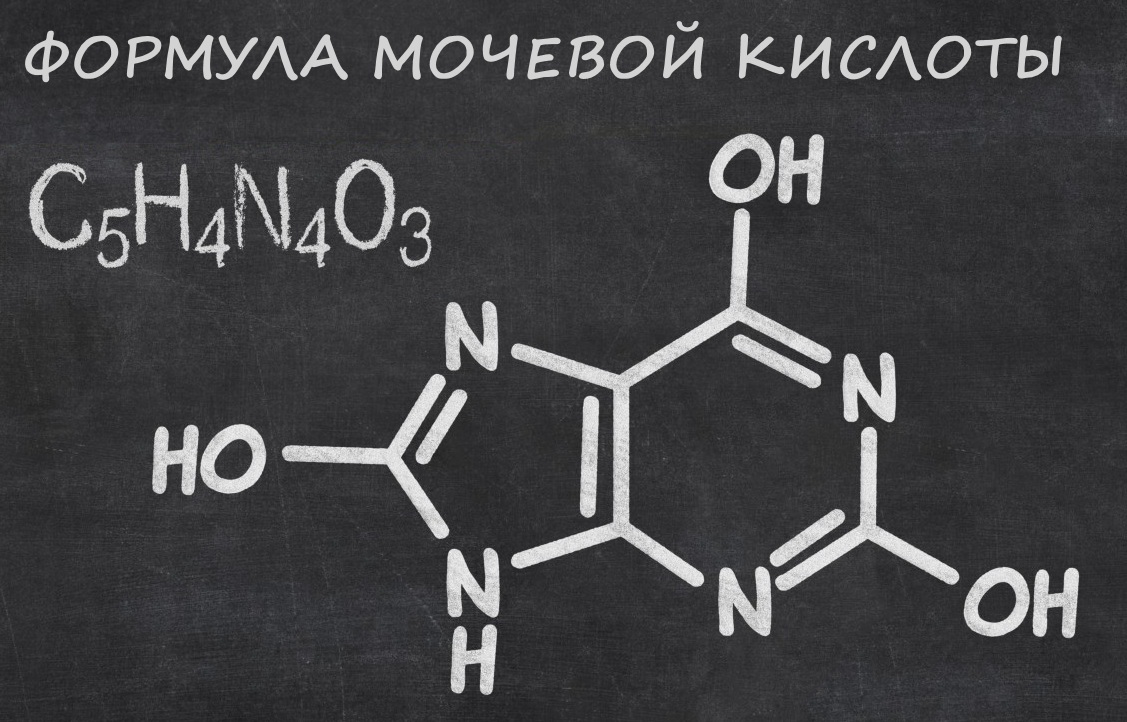
До її складу входять солі натрію і кальцію. Частка першого становить 90%. Крім солей, сюди входять водень, кисень, азот і вуглець.
Якщо сечова кислота вище норми - це свідчить про порушення процесу обміну. В результаті такого збою у людей відбувається відкладення солей в тканинах, і як наслідок розвиваються важкі захворювання.
функції
Незважаючи на те, що надлишок сечової кислоти, може завдати істотної шкоди організму, без неї все ж обійтися не можна. Вона виконує захисні функції і має корисні властивості.
Наприклад, в процесі білкового обміну, вона виступає в ролі каталізатора. Її вплив поширюється і на гормони, що відповідають за мозкову активність - адреналін і норадреналін. Це означає, що її наявність в крові допомагає стимулювати роботу головного мозку. Її дія подібно до кофеїну. Люди, у яких підвищений вміст сечової кислоти в крові з народження, більш активні та ініціативні.
Володіє кислота і антиоксидантними властивостями, що допомагають загоювати рани і боротися із запаленнями.
Виконує захисні функції. Вона бореться з вільними радикалами. В результаті знижується ризик появи і розвитку доброякісних і ракових пухлин.
здача аналізу
 Подібний аналіз призначають, щоб визначити стан здоров'я хворого, а також, щоб діагностувати захворювання, яке могло викликати підвищення рівня сечової кислоти в крові. Для отримання правдивих результатів, необхідно попередньо підготуватися до здачі крові.
Подібний аналіз призначають, щоб визначити стан здоров'я хворого, а також, щоб діагностувати захворювання, яке могло викликати підвищення рівня сечової кислоти в крові. Для отримання правдивих результатів, необхідно попередньо підготуватися до здачі крові.
За 8 годин до відвідування лабораторії не можна їсти, забір біоматеріалу проводиться натщесерце. Слід виключити з меню гостру, солону і перчену їжу. Цієї дієти слід дотримуватися добу до здачі крові. В цей же період потрібно відмовитися від вживання алкогольних напоїв.
Сечова кислота більше норми може бути через стреси, емоційного перенапруження або фізичного навантаження напередодні здачі аналізу.
Спотворювати результати можуть і лікарські препарати з сечогінним ефектом, вітамін С, кофеїн, інсулін, бета-адреноблокатори і ібупрофен. Якщо відмовитися від подібних медикаментів не можна, то слід попередити лікаря перед здачею аналізу.
У лабораторії буде братися венозна кров. Результати дослідження готуються протягом доби.
показники норми
Якщо отримані результати біохімічного аналізу показали цифри відповідають даним наведеним в таблиці нижче, то все в нормі.
| Вікова категорія (років) | Норми сечової кислоти (мкмоль / л) | |
| Діти до 12 | 120-330 | |
| до 60 | чоловіки | 250-400 |
| жінки | 200-300 | |
| від 60 | чоловіки | 250-480 |
| жінки | 210-430 | |
| От90 | чоловіки | 210-490 |
| жінки | 130-460 | |
Як видно з таблиці, рівень з віком підвищується. Найбільше цифрове значення у літніх чоловіків - це норма сечової кислоти в крові, так як потреба в білках у чоловічого організму вище. Це означає, що продукти багаті пурином вони споживають більше і як результат - підвищена сечова кислота в крові.
Що може викликати відхилення від норми?
Рівень сечової кислоти в крові залежить від рівноваги 2-х процесів:
- Синтезу білка;
- Інтенсивності виведення кінцевих продуктів обміну.
Коли відбувається збій, який може спровокувати збільшення відсотка змісту в крові цієї кислоти. Концентрації сечової кислоти в плазмі крові вище нормального діапазону позначається як гіперурикемія, концентрація нижче норми - гіпоурікемія. Концентрації сечової кислоти в сечі вище і нижче норми відомі як гіперурикозурія і гіпоурікозурія. Рівні сечової кислоти в слині можуть бути пов'язані з рівнем сечової кислоти в крові.
Причини гіперурикемії:
- Прийом діуретиків (сечогінних речовин);
- Зниження інтенсивності екскреції нирками;
- токсикоз;
- алкоголізм;
- Ниркова недостатність;
- Недоїдання або тривале голодування.
Підвищений вміст може виникнути і при захворюваннях, таких як, СНІД, цукровий діабет, рак і ін.
Варто відзначити, що навіть незначно підвищений рівень цієї речовини, може стати причиною утворення твердих опадів в органах і тканинах.
підвищений показник
Тепер дізнаємося, чому сечова кислота в крові підвищена: причини, симптоми і наслідки.
У медицині гиперурикемию поділяють на два типи: первинну і вторинну.
первинна гіперурикемія
Даний тип є вродженим або ідіопатичним. Подібна патологія зустрічається з частотою 1%. У таких хворих є дефект в ферментації, що відбивається на обробці пурину. У підсумку високий вміст сечової кислоти в крові.
Поява вторинної гіперурикемії може виникнути через неправильне харчування. Вживання у великих кількостях продуктів містять пурин може істотно підвищити виведення сечової кислоти з сечею.
Гіперурикемія цього типу може бути пов'язана з такими станами:
Подагра - хворобливий стан, викликаний голчастими кристалами сечової кислоти, беруть в облогу в суглобах, капілярах, шкірі та інших тканинах. Подагра може виникнути, якщо рівень сечової кислоти в сироватці досягає 360 мкмоль / л, але бувають випадки, коли значення сечової кислоти в сироватці доходить до 560 мкмоль / л, але подагри не викликає.
У людському організмі пуринів метаболізуються в сечову кислоту, яка потім виводиться з сечею. Регулярне споживання деяких видів багатих пурином продуктів - м'яса, особливо ліверу яловичини і свинини (печінка, серце, мова, нирки) і деяких видів морепродуктів, включаючи анчоуси, оселедець, сардини, мідії, гребінці, форель, пікшу, скумбрію і тунець. Існують і продукти, вживання яких менш небезпечно: індичатина, курятина і кролятина. Помірне споживання багатих пурином овочів не пов'язане з підвищеним ризиком подагри.
Синдром Леша-Нігай
Це надзвичайно рідкісне спадкове розлад, також пов'язане з високим рівнем сечової кислоти в сироватці. При цьому синдромі спостерігаються спастичность, мимовільне рух і когнітивна відсталість, а також прояви подагри
Гіперурикемія може збільшити фактори ризику серцево-судинних захворювань
Камені в нирках
Рівні насичення сечової кислоти в крові можуть привести до однієї форми каменів в нирках, коли урати кристалізуються в нирках. Ці камені сечової кислоти є радіолюмінесцентний і тому не з'являються на рентгенограмі черевної порожнини. Кристали оцтової кислоти також можуть сприяти утворенню каменів оксалату кальцію, діючи як «приманок кристали»
Синдром Келлі-Сігміллера;
Підвищена активність синтезу фосфорібозілпірофосфат синтетази (збій в обміні речовин).
Пацієнти з даним захворюванням роблять біохімічний аналіз на підвищення сечової кислоти щорічно.
вторинна гіперурикемія
Дане явище може бути ознакою таких захворювань:
- СНІД;
- Синдром Фанконі;
- Ракові пухлини;
- Цукровий діабет (Гиперурикемия може бути наслідком опірності до інсуліну при діабеті, а не його попередником);
- Опіки високого ступеня;
- Синдром гіпереозінофіліі.
Існують і інші причини підвищення сечової кислоти - збій у функціонуванні нирок. Вони не можуть вивести зайві кислоти з організму. В результаті можуть з'явитися камені в нирках.
Високий рівень сечової кислоти спостерігається при таких захворюваннях:
- пневмонія;
- туберкульоз;
- Отруєння метиловим спиртом;
- екзема;
- Черевний тиф;
- псоріаз;
- Бешиха;
- Лейкоз.
безсимптомна гіперурикемія
Бувають випадки, коли у хворого симптоматика захворювання відсутня, а показники підвищені. Даний стан називається безсимптомною гіперурикемією. Воно виникає при гострому подагричний артрит. Показники при даному захворюванні нестабільні. Спочатку начебто нормальний вміст кислоти, але через деякий час цифри можуть збільшитися в 2 рази. При цьому дані перепади на самопочуття пацієнта не відображаються. Таке протікання захворювання можливо у 10% хворих.
симптоми гиперурикемии
При гіперурикемії симптоми у різних вікових груп різні.
У зовсім маленьких захворювання проявляється у вигляді шкірних висипань: діатезів, дерматитів, алергії або псоріазу. Особливість подібних проявів - це стійкість до стандартних методів терапії.
У дітей старшого віку симптоматика дещо інша. У них може боліти живіт, бути несвязная мова і енурез.
Перебіг захворювання у дорослих супроводжується болем в суглобах. Першими в зону ураження потрапляють стопи і суглоби пальців рук. Потім хвороба поширює свою дію на колінні і ліктьові суглоби. У запущених випадках, шкірний покрив над зоною ураження червоніє і стає гарячим. Згодом у хворих починає боліти живіт і поперек під час сечовипускання. Якщо своєчасно не вжити заходів, то постраждають судини і нервова система. Людини мучитимуть безсоння і головний біль. Все це може привести до інфаркту, стенокардії та гіпертензії.
лікування
Деякі фахівці для того, щоб сечова кислота в крові була в нормі, призначають лікарські препарати. Але певна харчова дієта протягом решти життя є більш ефективним методом лікування.
Якщо у пацієнта була виявлена гіперурикемія, то лікування включає притримування дієти. У раціон хворого додатково включають:
Морквяний сік;
Березовий сік;
Насіння льону;
Сік селери;
Вівсяної відвар;
Журавлинний морс;
Настій з шипшини.
Ці трав'яні настої і соки сприяють якнайшвидшому розчиненню і вимиванню соляного осаду з організму.
Виключається жирне, м'ясні бульйони, смажене, солоне, копчене і мариновані продукти. М'ясо можна їсти тільки варене або запечене. Обмеження по прийому м'яса - 3 рази на тиждень.
Під особливим забороною алкогольні напої. У виняткових випадках, можна тільки 30 г горілки.
Віддавайте перевагу лужною мінеральною воді.
Вживання солі потрібно звести до мінімуму. В ідеалі краще взагалі від неї відмовитися.
Необхідно стежити за частотою прийому їжі. Голодування може тільки погіршити стан хворого і підвищити рівень сечової кислоти. Тому кількість прийомів їжі в день має бути 5-6 разів. Розвантажувальні дні проводити краще на кисломолочних продуктах і фруктах.
З меню слід виключити деякі види продуктів:
- щавель;
- салат;
- помідори;
- Виноград;
- шоколад;
- яйця;
- Кава;
- торти
- ріпа;
- Баклажан.
Зниженню рівня сечової кислоти сприяють яблука, картопля, сливи, груші, абрикоси. Слід стежити і за водним балансом - 2,5 л рідини в день має бути випито.
Лікувати високий рівень кислоти в крові можна і за допомогою фізіотерапевтичних процедур. Так плазмоферез допоможе очистити кров від надлишку солей. Не варто нехтувати і лікувальною гімнастикою. Ряд нескладних вправ (махи ногами, «велосипед», ходьба на місці і ін.) Допоможе в стабілізації метаболізму. Масаж також сприяє розщепленню солі сечової кислоти.
З лікарських препаратів прописуються комплекси, що володіють протизапальними, сечогінними і знеболюючі властивості. Виділяють 3 типи препаратів від гіперурикемії:
- Дія, яких направлено на виведення надлишків сечової кислоти: «Пробенецид»; "Ацетилсаліцилова кислота"; «Натрій бікарбонат»;
- Сприяють зниженню вироблення кислоти. Їх призначають пацієнтам, які перенесли сечокам'яною хворобою і тим, у кого діагностовано ниркова недостатність;
- Допомагають перевести сечову кислоту з тканини в кров, і сприяють її виведенню: «Цінховен».
Курс лікування передбачає діагностику і усунення супутніх захворювань і факторів їх викликали. Тим самим усуваючи причини, що викликали підвищення рівня сечової кислоти в крові. Якщо, то це негативно позначається на стані людини. На тканинах і органах осідає соляної осад. Лікування подібного відхилення різнобічне: дієта, фізіотерапія, медикаменти і народна медицина. Всі ці методики в комплексі можуть допомогти нормалізувати рівень кислоти.