Навчитися розслаблятися. Як? Або де знаходиться мій внутрішній гальмо? Ефекти активації симпатичних і парасимпатичних нервів ефекти парасимпатичної нервової системи
Зміни функції органів, які виникають при активації симпатичних і парасимпатичних провідників представлені в таблиці 6.
Неадренергических і нехолинергических відділ вегетативної нервової системи.
В даний час чітко показано, що серед провідників вегетативної нервової системи є волокна, які не містять в якості медіатора ацетилхолін або норадреналін. Такі нейрони отримали назву неадренергических, нехолинергических. Описано декілька десятків варіантів медіаторів в таких нейронах. У ряді випадків було виявлено, що один нейрон може містити до 5 різних видів медіаторів, функція яких не завжди до кінця зрозуміла.
Неадренергических нехолинергических система нейронів добре розвинена в метасимпатична відділі вегетативної нервової системи і вегетативних сплетеннях деяких внутрішніх органів (міокард). У таблиці 7 представлені відомості щодо ролі деяких з медіаторів даної групи.
Таблиця 6. Ефекти стимуляції симпатичних і парасимпатичних провідників.
|
орган |
симпатичні нерви |
парасимпатичні нерви |
||
|
райдужка (зіницю) цилиарное тіло секреція водянистої вологи |
секреції вологи секреції вологи |
ціклоспазм відтік вологи |
||
|
проводить |
автоматизм, збудливість, провідність скоротність |
автоматизм, збудливість, провідність |
||
|
шкірні, вісцеральні скелетних м'язів ендотелій |
констрикція дилятация дилятация |
синтез NO, дилятация |
||
|
бронхіоли |
розслаблення |
скорочення |
||
|
Шлунково-кишковий тракт гладкі м'язи сфінктери секреція залоз |
розслаблення скорочення |
скорочення розслаблення підвищення |
||
|
Сечостатева система гладкі м'язи сфінктери судини нирок геніталії чоловіків |
розслаблення скорочення вазодилятация еякуляція |
скорочення розслаблення ерекція, за рахунок NO |
||
|
Шкіра / потові залози терморегуляторні апокріновие |
активація активація | |||
|
метаболічні функції
|
глікогеноліз секреція реніну секреції інсуліну секреції інсуліну | |||
|
міометрій |
скорочення розслаблення |
скорочення |
||
Таблиця 7. Характеристика окремих медіаторів неадренергических
нехолинергических відділу вегетативної нервової системи.
|
медіатор |
можлива роль |
|
Виступає як котрансміттер в холінергічних і адренергічних нейронах, пригнічуючи секрецію медіатора. Частково гідролізується до аденозину. Як аденозин, так і АТФ реалізують ряд ефектів через сімейство пуринових рецепторів P 1 і Р 2 типів, надаючи гальмівну дію на гладкі м'язи кишечника, бронхів, судин і сечового міхура. Аденозин стимулює ноцицептори аферентних нервів. |
|
|
Забезпечує інотропний ефект щодо міокарда, розширює ниркові, коронарні і мозкові судини, впливаючи на D 1 і D 5 типи дофамінових рецепторів. Впливаючи на пресинаптичні D 2 рецептори гальмує секрецію медіаторів в ЦНС і на периферії. |
|
|
серотонін |
Впливаючи на пресинаптичні 5-НТ 1 рецептори гальмує секрецію норадреналіну. Викликає скорочення гладких м'язів, впливаючи на 5-НТ 2 тип рецепторів. Сприяє виділенню ацетилхоліну в сплетеннях кишечника і стимулює моторику кишечника за рахунок активації 5-HT 3 типи серотонінових рецепторів. Впливаючи на 5-НТ 3 рецептори аферентних провідників підвищує їх чутливість до ноцицептивних стимулам. |
|
Окис азоту (NO) |
Котрансміттер інгібіторних нейронів нервових сплетінь травного тракту, трахеї і органів малого тазу. |
|
енкефалінів |
Виступає в ролі медіатора гальмівних вставних нейронів. Пригнічує секрецію ацетилхоліну в нервових сплетеннях кишечника і знижує його перистальтику. |
|
Бере участь у формуванні почуття голоду. |
|
|
нейропептид Y |
Пригнічує секрецію води та електролітів в кишечнику. Котрансміттер в постгангліонарних нейронах симпатичної і парасимпатичної нервової системи. Викликає тривалу вазоконстрикцію, що не утсраняется -адреноблокаторами. |
|
Вазоактивний інтестинального пептид (VIP) |
Стимулює секрецію кишечника. Виступає в ролі гальмівного котрансміттера в мотонейронах кишкового сплетіння. Котрансміттер холинергических нейронів. Надає вазоділятірующее і кардіостімулірующее дію. |
|
субстанція Р |
Стимулюючий котрансміттер в холінергічних сплетеннях кишечника. Виступає в ролі медіатора в аферентних сплетеннях міокарда. Вазоділятірующее дію за рахунок індукції синтезу і секреції NO |
1В мозковій речовині надниркових залоз людини секретується 80% адреналіну і тільки 20% норадреналіну. Цікаво відзначити, що у амфібій будова симпатичного відділу має протилежний характер - роль нейромедіатора виконує адреналін, а норадреналін є гормоном адреналової залози (аналога наднирників), зміст якого в ній досягає 80%. У деяких акул адреналової залози представлені двома окремими утвореннями, кожне з яких секретує або тільки адреналін, або норадреналін.
Ефекти активації парасимпатичної системи. Парасимпатичні нерви регулюють процеси, пов'язані з засвоєнням енергії (прийом, перетравлювання і всмоктування їжі) і її зберіганням. Ці процеси відбуваються, коли організм знаходиться в стані спокою і допускає зменшення дихального об'єму (підвищений тонус бронхів) і зниження інтенсивності серцевої діяльності.
секреція слини і кишкового соку сприяє переварюванню їжі: посилення перистальтики і зниження тонусу сфінктерів прискорюють транспорт кишкового вмісту. Спорожнення сечового міхура (сечовипускання) відбувається за рахунок напруги його стінки внаслідок активації детрузора з одночасним зниженням тонусу сфінктерів.
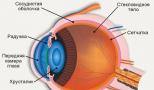
Активація парасимпатичних волокон, Иннервирующих очне яблуко, викликає звуження зіниці і збільшує кривизну кришталика, що дозволяє розглядати предмети на близькій відстані (акомодація).
Анатомія парасимпатичної системи. Тіла прегангліонарних парасимпатичних нейронів розташовані в стовбурі головного мозку і в крижовому відділі. Парасимпатичні волокна, що відходять від ядер стовбура головного мозку, йдуть в складі:
1) III черепного (окорухового) нерва і через ресничний вузол направляються до ока;
2) VII (лицевого) черепного нерва через крилопіднебінної і подверхнечелюстной вузли відповідно до слізної і слинних (під'язикової і піднижньощелепної) залозам;
3) IX (язикоглоткового) черепного нерва через вушної вузол до привушної слинної залози;
4) X (блукаючого) черепного нерва до інтрамуральним ганглиям органів грудної та черевної порожнин. Близько 75% всіх парасимпатичних волокон проходять в складі блукаючого нерва. Нейрони крижового відділу спинного мозку іннервують дистальний відділ ободової кишки, пряму кишку, сечовий міхур, дистальний відділ сечоводів і зовнішні статеві органи.
Ацетилхолін як нейромедіатор. АХ виділяється в закінченнях всіх постгангліонарних волокон, служить медіаторомв гангліонарних синапсах як симпатичного, так і парасимпатичного відділу ВНС, а також рухових кінцевих пластинок поперечно-смугастих миши. Слід зазначити, що ці синапси містять рецептори різних типів. Присутність різних типів холінорецепторів в різних холинергических синапсах уможливлює виборче фармакологічний вплив.
Мускаринові холінорецептори діляться на п'ять підтипів (М 1 -М 5), однак вибірково впливати на них фармакологічними засобами поки не вдається.

© Р.Р.Венцель, Ю.В.Фурменкова, 2002 г.
УДК 611.839-08
Надійшла 8.11.2001 р
Р.Р.Венцель, Ю.В.Фурменкова
Державна медична академія, Нижній Новгород;
Університетська клініка, г.Ессен (Німеччина)
Антигіпертензивні препарати і симпатична нервова система
Симпатична нервова система (СНС) є важливим регулятором серцево-судинної діяльності. Її активність визначається психологічними, нервовими і гуморальними факторами. Активація нейрогуморальних систем, також як і порушення локальних механізмів регуляції, грає важливу роль в розвитку і прогнозуванні серцево-судинних захворювань.
Активність СНС підвищується з віком незалежно від наявності патологічних станів 2. При застійної серцевої недостатності значне збільшення симпатичної активності корелює з показниками смертності 3. Гиперсимпатикотония сприяє розвитку ішемії міокарда внаслідок рефлекторної тахікардії і звуження коронарних судин, поєднується з наявністю артеріальної гіпертонії (АГ), інсулінорезистентності та високого ризику розвитку серцево-судинних ускладнень 4, 5. Хоча внесок СНС в розвиток АГ суперечливий, роль гіперсимпатикотонії на ранніх стадіях захворювання не викликає сумнівів 6-8. Вважають, що есенціальна АГ асоціюється з підвищеною симпатичної активністю на рівні центральної нервової системи 2, 7, 9. Однак не виключено, що в результаті взаємодії нейрональних сплетінь і провідних шляхів, що беруть участь в регуляції симпатичної активності на центральному рівні, артеріальний тиск (АТ) і ризик судинних ускладнень можуть знижуватися. Фармакотерапія АГ і її вплив на активність СНС послужили темою даної статті.
Регуляція симпатичної нервової системи
Еферентні волокна довгастого мозку з'єднують його з судинного центру. Іннервація внутрішніх органів здійснюється двома нейронами, об'єднаними в ганглій. Міелінізірованние аксони прегангліонарних нейронів грудного і поперекового відділів спинного мозку підходять до постгангліонарних нейронів симпатичного стовбура і превертебральних ганглиям. Медіатором проведення нервового імпульсу від пресинаптического до постсинаптичні нейрон служить ацетилхолін, що зв'язується з никотіночувствітельнимі рецепторами. У передачі імпульсу до еффекторним органів бере участь медіатор адренергічнихрецепторів норадреналін.
Катехоламіни адреналін, норадреналін і допамін виробляються в надниркових залозах, філогенетично є ганглієм. У периферичних судинах симпатична активація викликає вазоконстрикцію, опосредуемую дією b1-адренорецепторів на клітини гладеньких м'язів і b-адреноблокатори - на серце. Експериментальні та перші клінічні дані показали, що a2-адренорецептори мають вторинне значення в симпатичної регуляції серцево-судинної системи, але a2-адренорецептори ендотелію безпосередньо беруть участь в адренергической вазоконстрикції 10, 11.
СНС взаємодіє з ренінангіотензинової системою (РАС) і судинним ендотелієм. Ангіотензин (АТ) II впливає на звільнення і зворотне захоплення норадреналіну пресинаптичними рецепторами 12 і активує СНС через центральні механізми 13, 14. Більш того, стимуляція b1-адренорецепторів юкстагломерулярного апарату призводить до активації РАС за рахунок збільшення концентрації реніну 15; цей механізм, також як і затримка натрію і води, сприяє підвищенню артеріального тиску.
Вироблення в пресинаптичних рецепторах норадреналіну крім гістаміну, допаміну і простагландинів гальмує і сам норадреналін за механізмом зворотного регуляції, тоді як пресинаптическое звільнення норадреналіну стимулюють адреналін і АТ II.
Методи вивчення активності симпатичної нервової системи
Існують різні способи дослідження активності СНС. До добре відомим непрямими методами відносяться вимірювання артеріального тиску, швидкості кровотоку і частоти серцевих скорочень (ЧСС). Однак інтерпретація цих даних утруднена, так як реакція ефекторних органів на зміну симпатичної активності уповільнена і залежить також від локальних хімічних, механічних і гормональних впливів. У клінічній практиці активність СНС визначається за концентрацією норадреналіну в плазмі крові. Але рівень норадреналіну як адренергического нейромедіатора, що звільняється з синаптичних закінчень, теж є непрямим показником. Крім того, плазмова концентрація норадреналіну відображає активність не тільки адренергічних нейронів, але і надниркових залоз. Способи вимірювання катехоламінів плазми мають різний ступінь точності 16, тому заслуговують на увагу й інші методи, такі як дослідження варіабельності серцевого ритму і артеріального тиску 17, 18.
Мікронейрографія дозволяє безпосередньо визначати шкірну або м'язову симпатичну активність периферичного нерва 19, 20. Нервові імпульси реєструються в момент їх виникнення, причому можна не тільки спостерігати за їх змінами у відповідь на стимуляцію, а й проводити моніторування 19-23. Це прямий метод вимірювання активності СНС довгастого мозку. Нові досягнення мікронейрографіі дають можливість характеризувати зміни активності симпатичних нервів у відповідь на прийом серцево-судинних препаратів і аналізувати фармакокинетические можливості останніх 24.
Крім того, інформацію про вплив СНС на ефекторні органи дають вимір систолических інтервалів, кардіоімпедансографія, плетизмография і лазер-доплерографія 16, 25-28.
Вплив препаратовна симпатичну нервову систему
Бета-адреноблокатори
Антагоністи b-блокатори зменшують позитивну інотропну і хронотропное дію катехоламінів, опосредуемое через b1-адренорецептори і b2-адренозавісімую релаксацію гладких м'язів судин 29-32. Крім того, блокада b-адреноблокатори гальмує такі метаболічні ефекти катехоламінів, як ліполіз або глікогеноліз 31.
При лікуванні серцево-судинних захворювань селективна блокада b1-рецепторів оберігає серце від надмірної симпатичної стимуляції, зменшуючи частоту і силу серцевих скорочень, а внаслідок цього - і споживання міокардом кисню 31.
Бета-адреноблокатори є препаратами вибору в лікуванні АГ та ішемічної хвороби серця (ІХС), оскільки вони зменшують смертність, частоту ішемічних епізодів, ризик первинних і повторних інфарктів міокарда, раптової коронарної смерті 33-36.
В останні роки антагоністи b-адреноблокатори стали застосовуватися в терапії застійної серцевої недостатності 37-39. Позитивна дія блокади b-адренорецепторів при серцевій недостатності, що веде, мабуть, на краще функціонуванню СНС, спостерігається у бісопрололу 40, метопрололу 41 і карведилолу 42. Доведено, що ці препарати не тільки покращують гемодинаміку і клінічну симптоматику, але і знижують смертність 42, 43, хоча на початку лікування, в період підбору адекватної дози у випадках тяжкої серцевої недостатності, смертність може зростати. Таким чином, антагоністи b-блокатори поліпшують чутливість останніх до їх агонистам 44. На центральну ланку симпатичної нервової системи b-блокада надає протилежний ефект, який вивчений недостатньо 45, 46. Хоча активність симпатичних нервів збільшувалася при внутрішньовенному введенні b1-селективного b-адреноблокатора метопрололу пацієнтам з нелеченной АГ 45, при тривалому прийомі цього препарату вона знижувалася 46. Цікаво, що дія селективних b1- і неселективних b-адреноблокаторів на активність СНС різниться, по крайней мере, після першого прийому здоровими добровольцями. При цьому рівень катехоламінів в плазмі істотно підвищується після призначення b1-селективного b-адреноблокатора бісопрололу, тоді як прийом неселективного b-адреноблокатора пропранололу не впливає на плазмову концентрацію норадреналіну 29, 31.
діуретики
Діуретики гальмують реабсорбцію солей і води в канальцях, що зменшує перед- і постнавантаження. Посилене виділення іонів солей і води під дією діуретиків активує не тільки вазопресин, ренін-ангіотензин-альдостеронову систему, але і СНС, що компенсує порушення водно-сольового балансу 47.
нітрати
Нітрати як периферичні вазодилататори викликають ендотелій-залежне розслаблення гладких м'язів судин. До побічних дій деяких препаратів цієї групи відноситься рефлекторна тахікардія. У подвійному сліпому плацебо дослідженні изосорбид-динітрат помітно збільшував як ЧСС, так і, за даними мікронейрографіі, активність СНС 24. Це підтверджує результати вивчення дії інших вазодилататорів при їх внутрішньовенному введенні 48-50. Подібний ефект можна пояснити тим, що слідом за можливим зниженням центрального венозного тиску зменшується пульсовий тиск і відбувається активація барорецепторів 24.
Інші вазодилататори, включаючи a1-адреноблокатори
Вазодилататори миноксидил і гідролазін ефективно знижують АТ, зменшуючи перед- і постнавантаження. Однак вони стимулюють СНС, тому при тривалому лікуванні переважає компенсаторна активація симпатичної і ренінангіотензинової систем 51.
Селективні антагоністи a1-адреноблокатори, такі як празозин, також знижують перед- і постнавантаження за рахунок гальмування периферичної симпатичної вазоконстрикції, але не впливають на симпатичну активність міокарда, оскільки в ньому знаходяться в основному b-адренорецептори 52. Це пояснює, чому дослідження VACS (Veterans Administration Cooperative Study), в якому використовувався празозин, не підтвердило поліпшення прогнозу у пацієнтів з серцевою недостатністю 53. Слід зазначити, що антагоніст a1-адреноблокатори доксазозин в порівнянні з плацебо значно активує СНС, як в спокої, так і при фізичному навантаженні 29, 54.
Антагоністи іонів кальцію
Антагоністи кальцію (АК) викликають периферичну вазодилатацію і інгібування впливу вазоконстрикторов на гладком'язових мускулатуру внаслідок блокади повільних кальцієвих каналів L-типу і зменшення транспорту іонів кальцію. Зниження внутрішньоклітинної концентрації останніх гальмує електромеханічні процеси, що веде до вазодилатації і зниження артеріального тиску. Представники трьох груп антагоністів кальцію - дигидропиридинового (ніфедипін), фенілалкіламінового (верапаміл) і бензодіазіпінового (дилтіазем) типів пов'язують різні ділянки a1-субодиниці кальцієвого каналу. Якщо препарати групи дигідропіридину є переважно периферійними вазодилататорами, то речовини, подібні верапамилу, можуть безпосередньо впливати на синоатріальний вузол і, ймовірно, зменшувати активність СНС.
АК роблять позитивний антигіпертензивний і антиішемічний дії 55. Більш того, вони мають сосудопротектівнимі можливостями, покращують функцію ендотелію при атеросклерозі і АГ, як в експерименті, так і при лікуванні пацієнтів з АГ 56, 57. АК гальмують проліферацію клітин гладких м'язів коронарних артерій людини 58 і, в деякій мірі, прогресування атеросклерозу 59-67.
Незважаючи на сосудопротектівний ефект, клінічні дослідження АК у пацієнтів з ІХС, порушенням функції лівого шлуночка, діабет не дали позитивного результату 60-67.
Активація СНС залежить не тільки від групи використовуваних АК, але і від їх фармакокінетики. Наприклад, АК групи дигідропіридину (тобто ніфедипін, фелодипін, амлодипін) підвищують активність СНС і викликають рефлекторну тахікардію 68, 69. Навпаки, верапаміл зменшує ЧСС і, як показує дослідження норадреналіну плазми, активність СНС 70. Одноразовий прийом здоровими добровольцями ніфедипіну, за даними мікронейрографіі, збільшував тонус СНС, що було характерно для препаратів і короткого, і тривалого дій. Однак ніфедипін по-різному впливає на симпатичні нерви, які підходять до серця і судинах. Так, ритм серця не був точним показником стану СНС і незначний приріст ЧСС свідчив про зниження симпатичної активності 68.
Амлодипін, новий АК пролонгованої дії, по-видимому, стимулює СНС в меншій мірі, ніж інші препарати дигідропіридинового ряду. Хоча під час гострого медикаментозного тесту з амлодипіном ЧСС і рівні норадреналіну в плазмі у хворих АГ значно підвищувалися, але при тривалому прийомі впливу на серцевий ритм не спостерігалося 69.
Інгібітори ангіотензинперетворюючого ферменту
Блокуючи ензим, інгібітори ангіотензинперетворюючого ферменту (АПФ) порушують синтез АТ II, потужного вазоконстриктора, що збільшує звільнення норадреналіну за рахунок стимуляції периферичних пресинаптичних рецепторів 71. Більш того, АТ II стимулює активність центрального відділу СНС 72. Вважають, що інгібітори АПФ також запобігають пригнічення синтезу брадикініну і тим самим сприяють вазодилатації. Брадикинин сприяє звільненню оксиду азоту та простацикліну з ендотелію, що підсилює гемодинамическую реакцію на блокаду АПФ. Однак брадикинин може надавати і побічні дії - зокрема, кашель і судинний набряк 73-77.
На відміну від вазодилататорів (нітратів або антагоністів кальцію), що активують СНС, інгібітори АПФ не викликають рефлекторної тахікардії і підвищення рівня норадреналіну плазми 78. У подвійному сліпому плацебо дослідженні інгібітор АПФ каптоприл після внутрішньовенного введення здоровим добровольцям зменшував активність симпатичних нервів, незважаючи на зниження артеріального тиску, не змінював реакції на психічний або фізичний стрес, тоді як нітрати викликали виражену активацію СНС 3, 24. Таким чином, зниження в плазмі концентрації АТ II, стимулюючого активність СНС, знижує тонус СНС 72. Це - єдине можливе пояснення сприятливого впливу інгібіторів АПФ на виживаність пацієнтів з дисфункцією лівого шлуночка, у яких підвищений тонус СНС асоціювався з високою летальністю 79. Позитивна дія інгібіторів АПФ на захворюваність і смертність пацієнтів з серцевою недостатністю і порушенням функції лівого шлуночка, а також пацієнтів, які перенесли інфаркт міокарда, зареєстрований у багатьох клінічних дослідженнях 79-83.
Однак існує ряд механізмів, які частково нівелюють сприятливі ефекти інгібіторів АПФ, відмічені при гострому внутрішньовенному введенні. Перш за все АТ II може синтезуватися альтернативним шляхом, не залежних від АПФ, - за допомогою хімаз; при цьому в меншій мірі пригнічується СНС 84-86. З іншого боку, встановлено, що постійне пригнічення АПФ не змінює біосинтез, накопичення і звільнення катехоламінів 87. Оскільки брадикинин дозозависимо стимулює звільнення норадреналіну, навіть під час блокади конвертує фермент, можна вважати, що він компенсує відсутність ефекту від інгібіторів АПФ, сприяючи виділенню катехоламінів 87. При серцевої недостатності постійне лікування інгібіторами АПФ супроводжується помітним зниженням центральної симпатичної активності, можливо, внаслідок впливу на СНС постійно напружених барорефлекторного механізмів 88. Активність парасимпатичної нервової системи при гострому та постійному призначенні інгібіторів АПФ, мабуть, не змінюється, так як ці препарати не впливають на основні серцево-судинні рефлекси 89.
Антагоністи рецепторів ангіотензінаI типу
Блокада рецепторів АТ II - найпряміший шлях інгібування РАС. На відміну від інгібіторів АПФ, які не впливають на звільнення норадреналіну через гальмування його зворотного захоплення і метаболізму, активації компенсаторних механізмів, антагоністи рецепторів ангіотензину I типу (АТ I) in vitro пригнічують ангіотензин-індукований захоплення норадреналіну і, отже, його проліферативний ефект 90, 91.
Дія антагоністів АТ I-рецепторів в організмі людини in vivo поки вивчено недостатньо. Дослідження ефективності лозартану у літніх показало, що антагоніст АТ I-рецепторів лозартан в більшій мірі, ніж інгібітор АПФ каптоприл, впливав на захворюваність і смертність пацієнтів із симптоматичною серцевою недостатністю 92. Між групами хворих, які отримували лозартан і каптоприл, відмінностей в плазмової концентрації норадреналіну не відзначено.
Експериментальні дані показали, що антагоністи АТ I-рецепторів в більшій мірі, ніж інгібітори АПФ, пригнічують синтез катехоламінів 93. Встановлено, що новий непептідние антагоніст АТ I-рецепторів епросартан гальмує прессорную реакцію на роздратування спинного мозку у щурів, тоді як лозартан, валсартан і ірбезартан не впливають на СНС. Даний факт можна розцінити як більш виражене інгібування рецепторів АТ II 94.
Невідомо, чи будуть ці ефекти на СНС мати значення in vivo. Однак перші клінічні результати подвійного сліпого плацебо-контрольованого дослідження показали, що, щонайменше, лозартан не знижує активності СНС ні в спокої, ні після фізичного навантаження в порівнянні з плацебо або еналаприлом 54.
центральні симпатолітики
Колиндяни, гуафацін, гуанабенц і a-метил-ДОПА - широко відомі антигіпертензивні препарати, що діють на центральні a2-адренорецептори 95 і призводять до пригнічення СНС і зниження артеріального тиску, переважно в результаті вазодилатації і подальшого зниження периферичного судинного опору. Незважаючи на хороший гіпотензивний ефект, ці речовини більше не використовуються як засоби першої лінії в лікуванні АГ через їх небажаних побічних дій, таких як нудота, сухість у роті і сонливість. При застосуванні клонідину можливий також синдром відміни 96. Ці побічні ефекти пов'язані в основному з дією на a2-адренорецептори 97.
Зараз розпочато клінічне застосування нового покоління антигіпертензивних засобів центральної дії (наприклад, моксонидин і рилменідин) з меншою кількістю побічних ефектів. Встановлено, що вони в більшій мірі впливають на центральні імідазолін1-рецептори, ніж на a2-адренорецептори 97-99. На відміну від них інші центрально діючі гіпотензивні препарати (a-метил-ДОПА, гуанфацин, гуанабенц) взаємодіють переважно з центральними a2-рецепторами 95. У лабораторних тварин моксонидин пригнічував симпатичну іннервацію резистивних судин, серця і нирок 97, 100. Подвійне сліпе плацебо-контрольоване дослідження in vivo з прямим вимірюванням активності СНС методом мікронейрографіі вперше показало, що агоніст імідазолін1-рецепторів моксонідин знижує систолічний та діастолічний АТ внаслідок зменшення центрального тонусу СНС як у здорових добровольців, так і у нелікованих хворих АГ 68. Моксонидин зменшує симпатичну активність і рівень норадреналіну плазми у обстежених обох груп, тоді як концентрації адреналіну і реніну не змінювалися 68. ЧСС після прийому моксонідин зменшувалася у здорових осіб; у пацієнтів з АГ схильність до брадикардії спостерігалася лише в нічні години 68.
За здатністю контролювати артеріальний тиск моксонидин порівняємо з іншими антигіпертензивними засобами, такими як a- і b-адреноблокатори, антагоністи кальцію або інгібітори АПФ; побічні дії (нудота, сухість у роті) бувають менш виражені, ніж у клонідину та інших препаратів центральної дії попереднього покоління 30, 101.
Рілменідін - інший агоніст імідазолін1-рецепторів з ще більшою спорідненістю до останніх 102. Його застосування у пацієнтів показало ефективне зниження артеріального тиску з меншою кількістю побічних дій, ніж у клонидина 103-105. Рілменідін викликав таке ж, як антагоніст b-адреноблокатори атенолол, зниження артеріального тиску, але в порівнянні з ним переносився хворими краще. Однак на відміну від атенололу він не впливав на показники функції вегетативної нервової системи, такі як частота серцевого ритму під час фізичного навантаження і проба Вальсальви 106. Дія рилменидина на центральну СНС поки не вивчено.
Взаємодія симпатичної нервової системи і ендотелію судин
Ендотелій судин відіграє важливу роль в регуляції їх тонусу. Порушення секреції ендотелієм медіаторів може бути однією з ланок патогенезу і прогресування АГ і атеросклерозу. Експериментальні дані показали наявність різноманітних взаємодій між СНС і судинним ендотелієм. Ендотелін-1, що виробляється клітинами ендотелію, є найсильнішим вазоконстриктором; його концентрація в плазмі корелює з рівнем смертності від важких серцево-судинних захворювань 107, 108. Ендотелін викликає периферичну вазоконстрикцію і підвищення артеріального тиску; у щурів введення ендотеліну стимулює симпатичну активність 109. Крім того, ця речовина вважають комітогеном проліферації гладком'язових клітин судин 108.
Рецептори ендотеліну пов'язані з кальцієвими каналами за допомогою G-протеїнів 110. Цей факт може пояснити, яким чином антагоністи іонів кальцію зменшують ендотелій-залежну вазоконстікцію. Дослідження кровотоку в передпліччі показало, що верапаміл або ніфедипін, введені внутриартериально, запобігали констрикторную реакцію на внутрішньовенну інфузію ендотеліну 28. З іншого боку, препарати, що активують СНС (наприклад, нітрати і ніфедипін), підвищують концентрацію ендотеліну в плазмі у людини, тоді як інгібітори АПФ і моксонидин пригнічують активність СНС і не впливають на рівень ендотеліну 24, 111.
Тривала терапія антагоністами кальцію в експерименті та у пацієнтів з АГ покращує ендотелій-залежну релаксацію у відповідь на ацетилхолін 112. Інгібітори АПФ також стимулюють ендотелій-залежну релаксацію, гальмуючи інактивацію брадикініну, що веде до утворення оксиду азоту та простацикліну. При вивченні кровотоку в резистивних судинах у щурів зі спонтанною АГ встановлено, що тривала блокада РАС непептидним антагоністом рецепторів АТ II CGP 48369, інгібітором АПФ беназепрілом або антагоністом кальцію ніфедипіном знижує артеріальний тиск і покращує функцію ендотелію 56. Клінічні дослідження показали, що інгібітор АПФ квінаприл здатний викликати зворотний розвиток діастолічної дисфункції і зменшувати частоту коронарної ішемії 113-115. Призначення інгібітору АПФ лізиноприлу пацієнтам на гіпертонічну хворобу вибірково підсилює вазодилатацию у відповідь на введення брадикініну 116.
Різні інгібітори АПФ, наприклад квінаприл і еналаприл, в різному ступені покращують ендотелій-залежну вазодилатацію, володіючи, мабуть, різним спорідненістю до АПФ. Про це говорить той факт, що квінаприл, на відміну від еналаприлу, внаслідок збільшення кількості оксиду азоту сприяє дилатації судин у пацієнтів з хронічною серцевою недостатністю 117.
Експериментальні та перші клінічні дослідження шкірної мікроциркуляції у людини дають підставу припустити, що агоністи адренорецепторів стимулюють a-рецептори ендотелію, і це веде до звільнення оксиду азоту 10, 118. Дійсно, констрикція гладких м'язів судин, опосередкована a1-рецепторами, посилюється при інгібуванні оксиду азоту, як in vitro, так і in vivo 10, 118. Цей механізм може мати патофизиологическое значення в розвитку атеросклерозу і АГ, коли порушена функція ендотелію. Вплив інших препаратів на ендотелій до сих пір не з'ясовано.
висновок
Дія серцево-судинних препаратів на СНС має важливе значення. Однак в більшості випадків активність СНС вивчалася непрямими методами, такими як аналіз варіабельності серцевого ритму або катехоламінів плазми. На противагу їм мікронейрографія дозволяє безпосередньо оцінити проведення нервового імпульсу по центральним симпатичним волокнам.
Комплексна дія антигіпертензивних засобів на пресорні системи (СНС, РАС і ендотелін) важливо клінічно, особливо при лікуванні пацієнтів із захворюваннями серцево-судинної системи. Активація СНС є можливою причиною побічних дій багатьох препаратів. Той факт, що рівень норадреналіну плазми служить предиктором смерті хворих із серцевою недостатністю 3, 119, 120, дозволяє вважати, що у них підвищена активність СНС, це також можливо і у інших пацієнтів, особливо з АГ 121. Крім того, гіперактивність СНС може виявлятися у хворих на цукровий діабет і ішемічна хвороба серця, включаючи гострий коронарний синдром 122.
Відповідь на питання, чи сприяє позитивну дію антигіпертензивних препаратів на симпатичну нервову систему зниження серцево-судинної і загальної смертності, може бути отриманий за допомогою інвазивних досліджень.
література
Converse R.J., Jacobsen T.N., Toto R.D. et al. Sympathetic overactivity in patients with chronic renal failure. N Engl J Med 1992; 327: 1908-1912.
Yamada Y., Miyajima E., Tochikubo O., Matsukawa T. et al. Age-related changes in muscle sympathetic nerve activity in essential hypertension. Hypertens 1989; 13: 870-877.
Cohn J.N., Levine T.B., Olivari M.T. et al. Plasma norepinephrine as a guide to prognosis in patients with chronic congestive heart failure. N Engl J Med 1984; 311: 819-823.
Neri Serneri G.G., Boddi M., Arata L. et al. Silent ischemia in unstable angina is related to an altered cardiac norepinephrine handling. Circulation 1993; 87: 1928-1937.
Julius S., Gudbrandsson T. Early assotiation of sympathetic overactivity, hypertension, insulin resistence, and coronary risk. J Cardiovask Pharmacol 1992; 20 (Suppl 8): 40-48.
Noll G., Wenzel R.R., Schneider M. et al. Increased activation of sympathetic nervous system and endothelin by mental stress in normotensive offspring of hypertensive parents. Circulation 1996; 93: 866-869.
Anderson E.A., Sinkey C.A., Lawton W.J., Mark A.L. Elevated sympathetic nerve activity in bordeline hypertensive humans. Evidence from direct intraneural recordings. Hypertens 1989; 14: 177-183.
Philipp T., Distler A., \u200b\u200bCordes U. Sympathetic nervous system and blood pressure control in essential hypertension. Lancet 1978; 11: 959-963.
Wallin B.G., Morlin C., Hjemdahl P. Muscle sympathetic activity and venous plasma noradrenaline concentration during static exercise in normotensive and hypertensive subjects. Acta Physiol Scand 1987; 129: 489-497.
Wenzel R.R., Bruck H., Schaefers R.F., Michel M.C. The nitric-oxide inhibitor L-NMMA potenciates norepinephrine-induced vasoconstriction: effects of the alfa2-blocker yohimbine. Kidney Blood Press Res 1998; 21: 336-398.
Chen H.I., Li H.A.T., Chen C.C. Physical conditioning decreases norepinephrine-induced vasoconstriction in rabbits. Possible roles of norepinephrine-evoked endothelium-derived relaxing factor. Circulation 1994; 90: 970-975.
Hilgers K.F., Veelken R., Rupprecht G., Reeh P.W. et al. Angiotensin II facilitates sympathetic transmission in rat hind limb circulation. Hypertens 1993; 21: 322-328.
Kannan H., Nakamura T., Jin X.J., Hayashida Y. et al. Effects of centrally administered angiotensin on sympathetic nerve activity and blood flow to the kidney in conscious rats. J Auton Nerv Syst 1991; 34: 201-210.
Davis J.O., Freeman R.H. Mechanisms regulating renin release. Physiol Rev 1976; 56: 1-56.
Weber F., Brodde O.E., Anlauf M., Bock K.D. Subclassification of human beta-adrenergic receptors mediating renin-release. Clin Exp Hypertens 1983; 5: 225-238.
Schaefers R.F., Nuernberger J., Wenzel R.R., Philipp T. Characterization of adrenoreceptors mediating cardiovascular and in vivo effects of a-methylnoradrenaline (AMN) in humans. Naunun-Schmiedelberg's Arch Pharmacol 1997; 356: 52.
Pagani M., Lombardi F., Guzzetti S. et al. Power spectral analysis of heart rate and arterial pressure variabilities as a marker of sympathovagal interaction in man and conscious dogs. Circ Res 1986; 59: 178-193.
Esler M., Jennings G., Korner P., Blombery P. et al. Measurement of total and organ-specific norepinephrine kinetics in humans. Am J Physiol 1984; 247: 21-28.
Delius W., Hagbarth K.E., Hongell A., Wallin B.G. Manoeuvres affecting sympathetic outflow in human skin nerves. Acta Physiol Scand 1972; 84: 177-186.
Delius W., Hagbarth K.E., Hongell A., Wallin B.G. General characteristics of sympathetic activity in human muscle nerves. Acta Physiol Scand 1972; 84: 65-81.
Wallin B.G. Intraneural recordings of normal and abnormal sympathetic activity in man. In: S.R. Bannister, ed it. Autonimic failure. Oxford University Press; 1988; 177-195.
Victor R.G., Leimbach W.J., Seals D.R., Wallin B.G. et al. Effects of the cold pressor test on muscle sympathetic nerve activity in humans. Hypertens 1987; 9: 429-436.
Mark A.L., Victor R.G., Nerhed C., Wallin B.G. Microneurographic studies of the mechanisms of sympathetic nerve responses to static exercise in humans. Circ Res 1985; 57: 461-469.
Noll G., Wenzel R.R., de Marchi S., Shaw S. et al. Differential effects of captopril and nitrates on muscle sympathetic nerve activity in healthy volonteers. Circulation 1997; 95: 2286-2292.
Li Q., \u200b\u200bBelz G.G. Systolic time intervals in clinical pharmacology. Eur J Clin Pharmacol 1993; 44: 415-421.
Wenzel R.R., Duthiers N., Noll G., Bucher J. et al. Endothelin and calcium antagonists in the skin microcirculation of patients with coronary artery disease. Circulation 1996; 94: 316-322.
Creager M.A., Cooke J.P., Mendelsohn M.E. et al. Impaired vasodilatation of forearm resistance vessels in hypercholesterolemic humans. J Clin Invest 1990; 86: 228-234.
Kiowski W., Luescher T.F., Linder L., Buehler F.R. Endothelin-1-induced vasoconstriction in humans. Reversal by calcium channel blocade but not by nitrovasodilatators or endothelium-derived relaxing factor. Circulation 1991; 83: 469-475.
Schaefers R.F., Poller U., Ponicke K. et al. Influence of adrenoceptor and muscarinic receptor blocade on the cardiovascular effects of exogenous noradrenaline and of endogenous noradrenaline released by infused tyramine. Naunyn Schmiedeberg's Arch Pharmacol 1997; 355: 239-249.
Schaefers R.F., Loew-Kroeger A., \u200b\u200bPhilipp T. Wirksamkeit und vertraeglichkeit des neuen zentralwirksamen antihypertensivums moxonidin im vergleich zu enalapril. Nieren Hochdruck 1994; 23: 221-224.
Schaefers R.F., Nuernberger J., Herrmann B., Wenzel R.R. et al. Adrenoceptors mediating the cardiovascular and metabolic effects of alpha-methylnoradrenaline in man. J Pharmacol Exp Ther 1999; 289: 918-925.
Schaefers R.F., Adler S., Dail A. et al. Positive inotropic effects of the beta-2-adrenoceptor antagonist treatment. J Am Coll Cardiol 1994; 23: 1224-1233.
ISIS-1. Randomised trial of intravenous atenolol among 16027 cases of suspected acute myocardial infarction: ISIS-1. First International Study of Infarct Survival Collaborative Group. Lancet 1986; 17: 57-66.
Wikstrand J., Warnold I., Olsson G., Tuomilehto J. et al. Primary prevention with metoprolol in patients with hypertension. Mortality results from the MAPHY study; JAMA 1988; 259: 1976-1982.
The IPPSH Collaborative Group I. Cardiovascular risk and risk factors in a randomised trial of treatment based on the beta-blocker oxprenolol: the International Prospective Primary Prevention Study in Hypertension (IPPSH). The IPPSH Collaborative Group. J Hypertens 1985; 3: 379-392.
Erne P., Zuber M., Schuepfer G. Betablocker und koronare Herzkrankheit. In: T.F.Luescher, ed. It. Praeventive Kardiologie in Klinik und Praxis. Bern: Verlag Hans Huber; 1993: 231-234.
Waagstein F., Hjalmarson A., Varnauskas E., Wallentin I. Effect of chronic beta-adrenergic receptor blocade in congestive cardiomyopathy. Br Heart J 1975; 37: 1022-1036.
Engelmeier R.S., O, Connel J.B., Wals R., Rad N. et al. Improvement in symptoms and exercise tolerance by metoprolol in patients with dilated cardiomyopathy. A double-blind, randomised, placebo-controlled trial. Circulation 1985; 72: 536-546.
Gilbert E.M., Anderson J.L., Deitchman D. et al. Long-term beta-blocker vasodilatator therapy improves cardial function in idiopathic dilated cardiomyopathy. A double-blind, randomised study of bucindolol versus placebo. Am J Med 1990; 88: 223-229.
CIBIS Investigaters and Committees. A randomised trial of beta-blocade in heart failure. The cardiac insufficiency bisoprolol study (CIBIS). Circulation 1994; 90: 2153-2156.
Waagstein F., Bristow M.R., Swedberg K. et al. for the metoprolol in dilated cardiomyopathy (MDC) trial study group. Beneficial effects of metoprolol in idiopathic dilated cardiomyopathy. Lancet 1993; 342: 1441-1446.
Packer M., Bristow M.R., Cohn J.N. et al. for the U.S. Carvedilol Heart Failure Study Group. The effect of carvedilol on morbidity and mortality in patients with chronic heart failure. N Engl J Med 1993; 334: 1349-1355.
Lechat P., Escolano S., Goldmard J.L. et al. Prognostic value of bisoprolol-induced hemodynamic effects in heart failure during the Cardiac Insufficiency-Bisoprolol Study (CIBIS). Circulation1997; 96: 2197-2205.
Heilbrunn S.M., Shah P., Bristow M.R., Valantine H.A. et al. Increased beta-receptor density and improved hemodynamic response to catecholamine stimulation during long-term metoprolol therapy in heart failure from dilated cardiomyopathy. Circulation 1989; 79: 483-490.
Sundlof G., Wallin B.G., Stromgren E., Nerhed C. Acute effects of metoprolol on muscle sympathetic activity in hypertensive humans. Hypertens 1983; 5: 749-756.
Wallin B.G., Sundlof G., Stromgren E., Aberg H. Sympathetic outflow to muscles during treatment of hypertension with metoprolol. Hypertens 1984; 6: 557-562.
Burnier M., Brunner H.R. Neurohormonal consequences of diuretics in different cardiovascular syndroms. Eur Heart J 1992; 13 (Suppl G): 28-33.
Sanders J.S., Ferguson D.W. Diastolic pressure determines autonomic response to pressure perturbation in humans. J Appl Physiol 1989; 66: 800-807.
Ferguson D.W., Hayes D.W. Nifedipine potentiates cardiopulmonary baroreflex control of sympathetic nerve activity in healthy humans. Circulation 1989; 80; 285-298.
Hoffman R.P., Sinkey C.A., Kienzle M.G., Anderson E.A. Muscle sympathetic nerve activity is reduced in IDDM before overt autonomic neuropathy. Diabetes 1993; 42; 375-380.
Packer M. Vasodilatator and inotropic drugs for treatment of chronic congestive heart failure - distinguishing hype from hope. J Am Coll Cardiol 1988; 12: 1299-1317.
Mettauer B., Rouleau J.L., Bichet D. et al. Differential long-term intrarenal and neurohumoral effects of captopril and prazozin in patients with chronic congestive heart failure - importance of initial plasma renin activity. Circulation 1986; 73: 492-502.
Cohn J.N., Archibald D.G., Ziesche S. et al. Effect of vasodilatator therapy on mortality in chronic congestive heart failure. Results of a Veterans Administration Cooperative Study. N Engl J Med 1986; 314: 1547-1552.
Wenzel R.R., Wambach C., Schaefers R.F. et al. Doxasosin, but not losartan or enalapril, increases exercise-induced sympathetic activation. Kidney Blood Press Res 1998; 21: 336-398.
Nayler W.G., Szeto J. Effect of verapamil on contractility, oxygen utilisation and calcium exchangeability in mammalian heart muscle. Cardiovasc Res 1972; 6: 120-128.
Dohi Y., Criscione L., Pfeiffer K., Luescher T.F. Angiotensin blocade or calcium antagonists improve endothelial dysfunction in hypertension: studies in perfused mesenteric resistance arteries. J Cardiovasc Pharmacol 1994; 24: 372-379.
Taddei S., Virdis A., Ghiadoni L., Salvetti A. Endothelial dysfunction in hypertension: fact or fancy?
J Cardiovasc Pharmacol 1998; 32 (suppl 3): 41-47.
Yang Z., Noll G., Luescher T.F. Calcium antagonists inhibit proliferation of human coronary smooth muscle cells in responce to pulsatile stretch and platelet-derived growth factor. Circulation 1993; 88: 832-836.
Lichten P.R., Hugenholtz P.C., Rafflenbeul W., Hecker H. et al. Retardation of angiographic progression of coronary artery disease by nifedipine. Results of the International Nifedipine Trial on Antiatherosclerotic Therapy (INTACT). INTACT Group Investigators. Lancet 1990; 335: 1109-1113.
HINT. Early treatment of unstable angina in the coronary care unit: a randomised, double blind, placebo controlled comparison of recurrent ischaemia in patients treated with nifedipine or metoprolol or both. Report of The Holland Interuniversity Nifedipine / Metoprolol Trial (HINT) Research group. Br Heart J 1986; 56: 400-413.
Behar S., Rabinowitz B., Zion M. et al. Immediate and long-term prognostic significance of a first anterior versus first inferior wall Q-wave acute myocardial infarction. Secondary Prevention Reinfarction Israeli Nifedipine Trial (SPRINT) Study Group. Am J Cardiol 1993; 72; 1366-1370.
Estacio R.O., Schrier R.W. Antihypertensive therapy in type 2 diabetes: implications of the appropriate blood pressure control in diabetes (ABCD) trial. Am J Cardiol 1998; 82: 9-14.
SPRINT. Secondaryprevention reinfarction Israeli nifedipine trial (SPRINT). A randomised interventional trial of nifedipine in patients with acute myocardial infarction. The Israeli Sprint Study Group. Eur Heart J 1988; 9: 354-364.
Tatti P., Pahor M., Byington R.P. et al. Outcome results of the Fosinopril Versus Amlodipine Cardiovascular Events Randomised Trial (FACET) in patients with hypertension and NIDDM. Diabetes Care 1998; 21: 597-603.
Psaty B.M., Heckbert S.R., Koepsell T.D. et al. The risk of myocardial infarction assotiated with antihypertensive drug therapies. JAMA 1995; 274: 620-625.
Borhani N.O., Mercuri M., Birhani P.A. et al. Final outcome results of the Multicenter Isradipine Diuretic Atherosclerosis Study (MIDAS). A randomised controlled trial. JAMA 1996; 276: 785-791.
The Multicenter Diltiazem Postinfarction Trial Research Group. The effect of diltiazem on mortality and reinfarction after myocardial infarction. The Multicenter Diltiazem Postinfarction Trial Research Group. N Engl J Med 1988; 319: 385-392.
Wenzel R.R., Allegranza G., Binggeli C. et al. Differential activation of cardiac and peripheral sympathetic nervous system by nifedipine: role of pharmacokinetics. J Am Coll Cardiol 1997; 29: 1607-1614.
Lopez L.M., Thorman A.D., Mehta J.L. Effects of amlodipine on blood pressure, heart rate, catecholamines, lipids and response to adrenergic stimulus. Am J Cardiol 1990; 66: 1269-1271.
Kailasam M.T., Parmer R.J., Cervenka J.H. et al. Divergent effects of dihydropyridine and phenylalkylamine calcium channel antagonists classes on autonomic function in human hypertension. Hypertens 1995; 26: 143-150.
Saxena P.R. Interaction between the renin-angiotensin-aldosterone and sympathetic nervous system. J Cardiovasc Pharmacol 1992; 19: 580-588.
Matsukawa T., Goteh E., Minamisawa K. et al. Effects of intravenous infusions of angiotensin II on muscle sympathetic nerve activity in humans. Am J Physiol 1991; 261: 690-696.
Pitt B., Chang P., Timmermans P. Angiotensin II receptor antagonists in heart failure: rationale and design of the Evaluation of Losartan in the Elderly (ELITE) Studie. Cardiovasc Drugs Ther 1995; 9: 693-700.
Gavras I. Bradykinin-mediated effects of ACE inhibition. Kidney Int 1992; 42: 1020-1029.
Israeli Z.H., Hall W.D. Cough and angioneurotic edema assotiated with angiotensin-converting enzyme inhibitor therapy: a rewiew of the literature and pathophysiology. Ann Intern Med 1992; 117: 234-242.
Chalmers D., Dombey S.L., Lawson I.H. Post-marketing surveilance of captopril (for hypertension): a preliminary report. Br J Clin Pharmacol 1987; 24: 343-349.
Lacourciere Y., Brunne H., Irwin R. et al. Group at LcS. Effects of modulation of the renin-angiotensin-aldosterone system on cough. J Hypertens 1994; 12: 1387-1393.
Swedberg K., Eneroth P., Kjekshus J., Snapinn S. Effects of enalapril and neuroendocrine activation on prognosis in severe congestive heart failure (follow-up of the Consensus trial). Consensus Trial Study Group. Am J Cardiol 1990; 66: 40-44.
Kober L., Torp-Pederson C., Carlsen J.E. et al. A clinical trial of the angiotensin-converting enzyme inhibitor trandolapril in patients with left ventricular dysfunction after myocyrdial infarction. Trandolapril Cardiac Evaluation (TRACE) Study Group. N Engl J Med 1995; 333: 1670-1676.
Cohn J.N., Johnson G., Ziesche S. et al. A comparison of enalapril with hydralazine-isosorbide dinitrate in the treatment of chronic congestive heart failure. N Engl J Med 1991; 325; 303-310.
Pfeffer M.A., Braunwald E., Moye L.A. et al. Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction: results of the Survival and Ventricular Enlargement Trial. N Engl J Med 1992; 327: 669-677.
The SOLVD Investigators. Effects of enalapril on mortality and the development of heart failure in asymptomatic patients with reduced left ventricular ejection fraction. N Engl J Med 1992; 327: 685-691.
AIRE TAIREASI. Effect of ramipril on mortality and morbidity of survivors of acute myocardial infarction with clinical evidence of heart failure. Lancet 1993; 342: 812-818.
Urata H., Kinoshita A., Misono K.S., Bumpus F.M. et al. Identification of a highly specific chymase as the major angiotensin II-forming enzyme in the human heart. J Biol Chem 1990; 265: 2348-2357.
Miura S., Ideishi M., Sakai T. et al. Angiotensin II formation by an alternative pathway during exercise in humans. J Hypertens 1994; 12: 1177-1181.
Urata H., Strobel F., Ganten D. Widespread tissue distribution of human chymase. J Hypertens 1994; 12 (suppl 1): 17-22.
Dominiak P. Modulation of sympathetic control by ACE inhibitors. Eur Heart J 1994; 14 (suppl 1): 169-172.
Grassi G., Cattaneo B.M., Seravalle G. et al. Effects of chronic ACE inhibition on sympathetic nerve traffic and baroreflex control of circulation in heart failure. Circulation 1997; 96: 1173-1179.
Veerman D.P., Douma C.E., Jacobs M.C., Thien T. et al. Effects of acute and chronic angiotensin converting enzyme inhibition by spirapril on cardiovascular regulation in essential hypertensive patients. Br J Clin Pharmacol 1996; 41: 49-56.
Timmermans P., Wong P.C., Chin A.T. et al. Angiotensin II receptors and angiotensin II receptor antagonists. Pharmacol Rev 1993; 45: 205-251.
Brasch H., Sieroslawski L., Dominiak P. Angiotensin II increases norepinephrine release from atria by acting on angiotensin subtype I receptors. Hypertens 1993; 22: 699-704.
Pitt B., Segal R., Martinez F.A. et al. Randomised trial of losartan versus captopril in patients over 65 with heart failure (Evaluation of Losartan in the Elderly Study). Lancet 1997; 349: 747-752.
Rump L.C., Oberhauser V., Schwertfeger E., Schollmeyer P. Experimental evidence to support ELITE. Lancet 1998; 351: 644-645.
Ohlstein E.H., Brooks D.P., Feuerstein G.Z., Ruffolo R.R. Inhibition of sympathetic outflow by the angiotensin II receptors antagonist, eprosartan, but not by losartan, valsartan or irbesartan: relationship to differences in prejunctional angiotensin II receptor blocade. Pharmacol 1997; 55: 244-251.
Van Zwieten P.A. Central imidazoline (I1) receptors as targets of centrally actingantihypertensives: moxonidine and rilmenidine. J Hypertens 1997; 15: 117-125.
Rupp H., Maisch B., Brill C.G. Drug withdrawal and rebound hypertension: differential action of the central antihypertensive drugs moxonidine and clonidine. Cardiovasc Drugs Ther 1996; 10 (Suppl 1): 251-262.
Ernsberger P., Damon T.H., Graff L.M., Schaefer S.G. et al. Moxonidine, a centrally acting antihyper-tensive agent, is a selective ligand for I1-imidazoline sites. J Pharmacol Exp Ther 1993; 264: 172-182.
Bohmann C., Schollmeyer P., Rump L.C. Effects of imidazolines on noradrenaline release in rat isolated kidney. Naunyn Schmiedeberg's Arch Pharmacol 1994; 349: 118-124.
Michel M.C., Brodde O.E., Schnepel B. et al. Hidazoxan and some other alpha 2-adrenergic drugs also bind with high affinity to non-adrenergic site. Mol Pharmacol 1989; 35: 324-330.
Ernsberger P., Haxhiu M.A., Graff L.M. et al. A novel mechanism of action for hypertension control: moxonidine as a selective I1-imidazoline agonist. Cardiovasc Drugs Ther 1994; 8 (Suppl 1): 27-41.
Kuppers H.E., Jaeger B.A., Luszick J.H., Grave M.A. et al. Placebo-controlled comparison of the efficacy and tolerability of once-daily moxonidine and enalapril in mild-to-moderate essential hypertension. J Hypertens 1997; 15: 93-97.
Bricca G., Dontenwill M., Molines A., Feldman J. et al. The imidazoline preferring receptor: binding studies in bovine, rat and human brainstem. Eur J Pharmacol 1989; 162: 1-9.
McKaigue J.P., Harron D.W. The effects of rilmenidine on tests of autonomic function in humans. Clin Pharmacol Ther 1992; 52: 511-517.
Dollery C.T., Davies D.S., Duchier J., Pannier B. et al. Dose and concentration-effect relations for rilmenidine. Am J Cardiol 1988; 61: 60-66.
Weerssuriya K., Shaw E., Turner P. Preliminary clinical pharmacological studies of S3341, a new hypotensive agent, and comparison with clonidine in normal males. Eur J Clin Pharmacol 1984; 27: 281-286.
Reid J.L., Panfilov V., MacPhee G., Elliot H.L. Clinical pharmacology of drugs acting on imidazoline and adrenergic receptors. Studies with clonidine, moxonidine, rilmenidine, and atenolol. Ann NY Acad Sci 1995; 763: 673-678.
Omland T., Terje Lie R., Aakvaag A., Aarsland T. et al. Plasma endothelin determination as a prognostic indicator of 1-year mortality after acute myocardial infarction. Circulation 1994; 89: 1573-1579.
Wenzel R.R., Czyborra P., Luescher T.F., Philipp T. Endothelin in cardiovascular control: role of endothelin antagonists. Curr Hypertens Rep 1999; 1: 79-87.
Mosqueda-Garcia R., Inagami T., Appalsamy M., Sugiura M. et al. Endothelin as a neuropeptide. Cardiovascular effects in the brainstem of normotensive rats. Circ Res 1993; 72: 20-35.
Goto K., Kasuya Y., Matsuki N. et al. Endothelin activates the dihydropyridine-sensitive, voltage-dependent Ca (2+) channel in vascular smooth muscle. Proc Natl Acad Sci USA 1989; 86: 3915-3918.
Wenzel R.R., Spieker L., Qui S., Shaw S. et al.
I1-imidazoline agonist moxonidine decreases sympathetic nerve activity and blood pressure in hypertensives. Hypertens 1998; 32: 1022-1027.
Tschudi M.R., Criscione L., Novosel D., Pfeiffer K. et al. Antihypertensive therapy augments endothelium-dependent relaxations in coronary arteries of spontaneously hypertensive rats. Circulation 1994; 89: 2212-2218.
Mancini G.B., Henry G.C., Macaya C. et al. Angiotensin-converting enzyme inhibition with quinapril improves endothelial vasomotor dysfunction in patients with coronary artery disease. The TREND (Trial on Reversing ENdothelial Dysfunction) Study. Circulation 1996; 94: 258-265.
Schlaifer J.D., Wargovich T.J., O, Neill B.J. et al. Effects of quinapril on coronary blood flow in coronary artery disease patients with endothelial dysfunction. TREND Investigators. Trial on Reversing Endothelial Dysfunction. Am J Cardiol 1997; 80: 1594-1597.
Drexler H., Kurz S., Jeserich M., Munzel T. et al. Effect of chronic angiotensin-converting enzyme on endothelial function in patients with chronic heart failure. Am J Cardiol 1995; 76: 13-18.
Taddei S., Virdis A., Ghiadoni L., Mattei P. et al. Effects of angiotensin converting enzyme inhibition on endothelium-dependent vasodilatation in essential hypertensive patients. J Hypertens 1998; 16: 447-456.
Hornig B., Arakawa N., Haussmann D., Drexler H. Differential effects of quinaprilat and enalaprilat on endothelium function of conduit arteries in patients with chronic heart failure. Circulation 1998; 98: 2842-2848.
Cocks T.M., Angus J.A. Endothelium-dependent relaxation of coronary arteries by noradrenaline and serotonin. Nature 1983; 305: 627-630.
Leimbach W.N. Jr, Wallin B.G., Victor R.G., Ayward P.E. et al. Direct evidence from intraneural recordings for increased central sympathetic outflow in patients with heart failure. Circulation 1986; 73: 913-919.
Swedberg K., Eneroth P., Kjekshus J., Wilhelmsen L. Hormones regulating cardiovascular function in patients with severe congestive heart failure and their relation to mortality. CONSENSUS Trial Study Group. Circulation 1990; 82: 1730-1736.
Held P.H., Yusuf S., Furberg C.D. Calcium channel blockers in acute myocardial infarction and unstable angina: an overview. BMJ 1989; 299: 1187-1192.
McCance A.J., Forfar J.C. Cardiac and whole body noradrenaline kinetics in ischaemic heart disease: contrast between unstable anginal syndromes and pacing induced ischaemia. Br Heart J 1989; 61: 238-247.
Парасимпатична нервова система, лікування якої є необхідністю (якщо виникає потреба) - це частина автономної нервової системою, що контролює внутрішні органи людського організму. Це кишечник, шлунок, серце і т.д. Тому якщо виникли якісь проблеми - треба їх вирішувати.
Функції автономної нервової системи
Багато людей не знають, як працює автономна нервова система, оскільки в більшості випадків це здійснюється мимоволі. Наприклад, людина не бачить, як функціонують нервові судини. Велика частина автономних функцій є рефлексивними, а одні з них людина навіть контролює своєю свідомістю. Ось одні з найпоширеніших рефлексів, що відносяться до контрольованих:
- дихання;
- ковтання;
- Сексуальне збудження.
Парасимпатична нервова система (лікування цієї структури буде обговорено трохи пізніше) забезпечує гомеостаз, тому вона дуже важлива в плані вибору характеру вчинків і поведінки людини, що контролює головний мозок. Найчастіше так трапляється в небезпечних ситуаціях, які провокують стреси, внаслідок чого людина повинна сконцентрувати всі свої внутрішні сили на боротьбі з обстановкою. Те ж саме стосується, до речі, і розслаблюючих обставин, що сприяють відпочинку і фізичного відновлення людини.
структура АНС
Вона складається з кількох відділів:
- симпатичний;
- парасимпатический;
- Ентеральний.
Отже, перший відділ з перерахованих відповідає за реакції, які пов'язані з особливо напруженими ситуаціями. Саме через це підвищується кров'яний тиск і посилюється частота серцебиття. Симпатичні відділ відповідає за негайні дії людини в екстремальних ситуаціях. Ці дії також опосередковані такими хімічними речовинами, які виділяються в такі моменти організмом, як адреналін і норадреналін. Саме тому симпатична нервова система ще іменується "робочим нервом".
Парасимпатична нервова система

А ось парасимпатичний відділ вегетативної нервової системи, на відміну від попереднього виду, вважається "спокійним". Інакше кажучи - "нерв спокою". ПНС є своєрідною "перезаправку" відновлення і енергії. Саме вона відповідає за ті дії, які організм здійснює під час спокою, дрімоти, їжі або сексуального збудження.
Однак треба зазначити, що парасимпатичний тип нервової системи все одно пов'язаний з симпатичним. Вони не протилежні, аж ніяк - ці два відокремлюючи доповнюють один одного. Їх можна назвати взаємопов'язаним комплексом, який тримає в нормі емоційний баланс організму людини. Недарма між ними є зв'язок, регульована такими кислотами, як аденозинмонофосфат і гуанозинмонофосфат. Взяти, приміром, ситуацію, коли серцевий ритм сповільнюється, або навпаки, збільшується. Саме симпатична активація може привести стан в норму, повернувши нормальний ритм. Те ж саме, якщо у людини пресинаптическое гальмування, то тут допоможе парасимпатичний відділ.
баланс
Дуже важливо, щоб всі функції вегетативної нервової системи між собою були збалансовані і доповнювали один одного. Якщо будуть якісь порушення, або НЕ налагоджені взаємодії, то будуть з'являтися деякі обмеження в нервовій системі, що може привести до негативних наслідків.
Наприклад, якщо симпатичний відділ буде надто активний, то цілком ймовірно, що у людини виникне артеріальна гіпертензія, порушення в травній системі, а також з'явиться занепокоєння. У тому випадку, якщо порушиться баланс з парасимпатичної системі, то виникне знижений тиск і відчуття великої втоми. Загалом, якщо баланс буде порушений хоч десь - виникнуть проблеми.
В цілому погіршується самопочуття, з'являються сильні головні болі, безсоння, напруга, можливо навіть непритомність. Це, до речі, свідчить про вегетативної дистонії, яка є найпоширенішим захворюванням, якщо говорити про порушення в нервовій системі цього типу. І це - лише початок. Якщо захворювання почне розвиватися, то це може привести до порушення менструального циклу, сечовидільної або навіть статевої функцій. Найшкідливіше, що може бути - це безсоння, але і вона не проходить безслідно. Можливо почне розвиватися стрес, з яким багато хто намагається впоратися, вживаючи алкоголь, причому у великих кількостях. Але це все лише посилює. Тому якщо з'явилися якісь проблеми, то краще відразу йти до відповідного фахівця, який проведе ретельне обстеження і призначить правильне лікування.